之前的Review太长了,先准备一篇Paper备用。
Abstract
隔室的微流控平台是神经科学研究中的一个重要工具。但是,由于缺乏一种简单的制造方法来创建具有高长宽比特征的复杂设备架构,仍然无法充分利用该技术的潜力。在这里,提出了一种混合增材制造方法,用于制造开放的隔室的神经设备,该方法提供了更大的设备设计自由度,消除了对人工后处理的需求,并增加了系统的生物相容性。多材料整合方法的适用性允许定制设备架构,用于至少持续40天的健康人类干细胞衍生的神经元和星形胶质细胞的长期维护。
利用微观和宏观尺度的快速原型设计功能,一个原理验证的黑质纹状体途径的人类体外模型被创建。通过介绍微流控系统中新颖材料和独特结构的途径,该方法为神经科学研究以外的生物学研究提供了新的可能性。通过介绍微流控系统中新颖材料和独特结构的途径,该方法为神经科学研究以外的生物学研究提供了新的可能性。
Introduction
人脑的复杂性使其很难对在体内任一时刻同时发生的过程进行建模。但是,在分隔的微流控装置中培养神经元群以进行神经突导向可提供更好的手段,以解构正常发育和体外脑回路建立的时空复杂性。这种分隔装置已成为研究神经元微环境的广为应用的工具。它们通常由两个主要部分组成:用于培养物理分离的神经元群的微流控隔室和连接该隔室的微通道阵列,该阵列允许神经突向外生长,同时防止细胞迁移。自从40多年前第一次用Campenot室进行实验以来,分隔装置已经广泛用于研究突触可塑性、轴突损伤和转运、病毒感染、神经回路形成以及疾病过程。

微流控设备最常用的制造方法是软光刻技术,这是一种原型技术,软弹性体聚二甲基硅氧烷(PDMS)由光刻图案化的母模复制模制而成。透气性、透光率、低成本、易操作性和生物相容性等优点使PDMS成为微流控细胞生物学研究中最常用的材料。然而,即使经过数十年的软光刻技术进步,PDMS微设备和零件(例如,用于微接触印刷)仍然通过首先将液态弹性体倒在精细的微结构或纳米结构的模具上,然后反常地用锋利的工具手工切割出单个零件。这一步骤限制了整体的可重复性,可能会损坏微结构,并导致错位问题。此外,它限制了设计选项。例如,传统的软光刻技术不足以实现具有高宽高比的壁和明确定义的微结构的开放隔室设计。的确,之前已经寻求了这样的设计,例如使用混合模具制造方案和专用设备,并获得了不同程度的成功。
在本文中,我们开发了一种用于微流控设备制造的新型增材制造技术,该技术提供了一种简单而通用的方法,我们将其称为3D打印软光刻技术。该方法保留了传统软光刻技术的优点,同时最大程度地减少了设备的手动后处理,扩大了设计可能性,简化了高宽高比特征的制造,并允许通过控制弹性体的沉积来减少PDMS含量。此外,通过3D打印的软光刻技术,可以在各种尺度以精确定义的特征进行快速原型制作,并为将新材料引入软光刻工具箱提供了可能性。3D打印的设备为人类干细胞衍生的神经元、星形胶质细胞以及成人成纤维细胞(或就此而言,任何细胞培养物)直接重新编程的神经元的长期分化和维持提供了平台。为了展示这种新颖制造方法的潜力,我们进行了原理验证实验,在该实验中,我们使用人类神经干细胞的黑质纹状体途径进行了建模。 多巴胺能神经元在此途径中的退化是帕金森病(PD)的标志,并引起与之相关的典型运动症状。黑质纹状体通路的一个重要特征是多巴胺能投射从中脑腹侧到前脑背侧纹状体的方向性。通过利用快速原型方法进行微观结构设计,我们设计了微通道以最大限度地增加两个隔室间多巴胺能投射的单向生长。开发的设备不仅提供了体外研究PD的平台,而且还展示了3D打印的软光刻在神经科学领域的多用性。
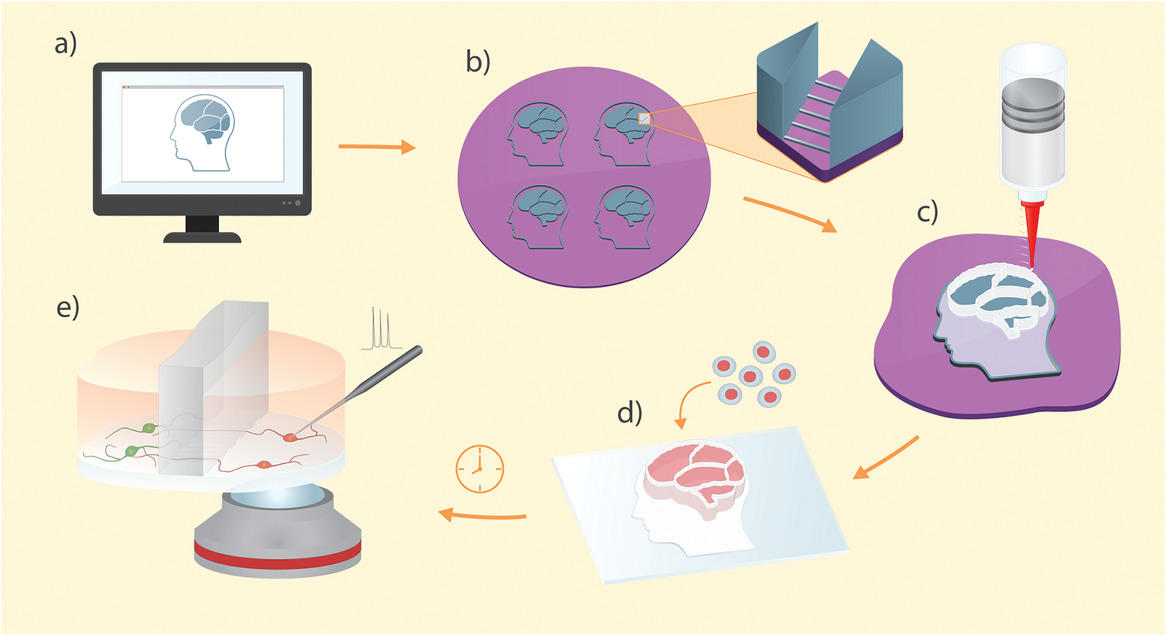
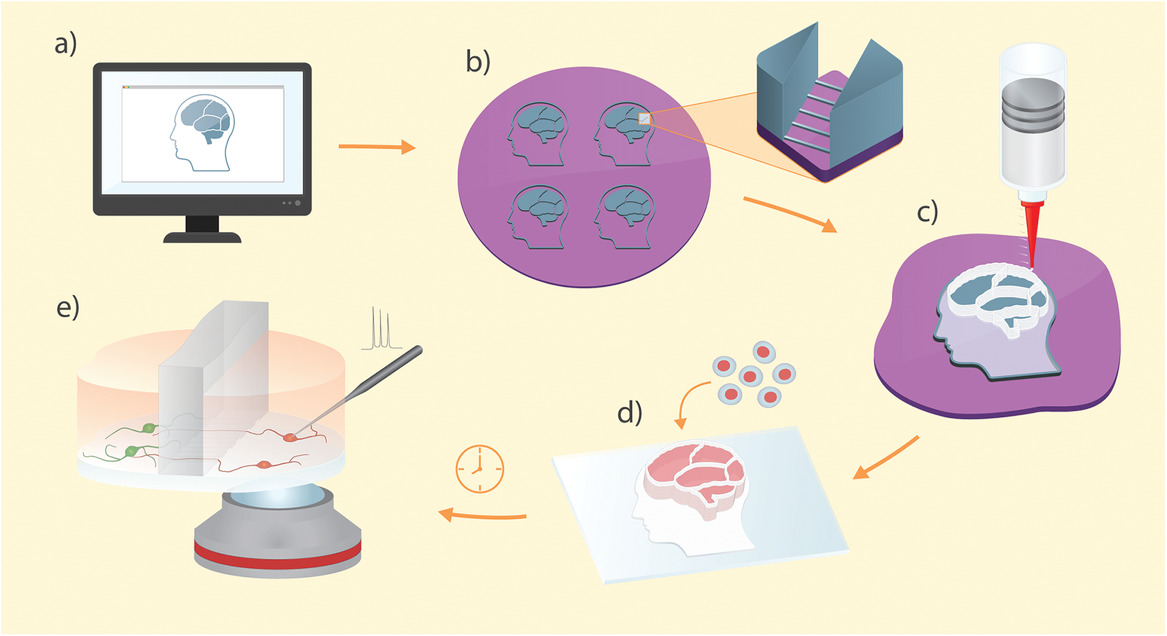
上图为3D打印的软光刻工艺的图形表示:
- a)在图形编辑软件中创建隔室的微流控设备的设计。
- b)使用标准光刻技术来制作具有微通道和开放隔室的复制特征的母模。
- c)该设备是通过将PDMS直接3D打印在母模上制成的。
- d)将单个装置从母模上剥离,并固定在玻片上,然后在隔室中播种并分化细胞。
- e)健康的神经元在设备上生成,并通过微通道阵列相互连接。该设备设计允许直接光学和物理访问目标细胞。
Results
3D‐Printed Soft Lithography
通过注射器喷嘴的压力驱动挤压,PDMS分两步直接3D打印到包含母模图案的硅晶片上。为此,配制了两种墨水:一种用于流动性的“垫片墨水”,用于高保真度模铸而不会有气泡;另一种用于“隔室”的墨水,用于制造垂直结构。墨水是通过将两种类型的具有不同流变特性的市售弹性体(Sylgard 184和Dowsil SE 1700)混合而制成的。Sylgard 184是一种液体弹性体,广泛用于常规软光刻中,而SE 1700是剪切稀化PDMS弹性体,其材料特性非常适合3D打印应用,包括开放式井结构。
通过调节作为基本组分的Sylgard 184的流变学来创建垫片墨水。这种弹性体的普通形式表现为牛顿流体,没有足够高的粘度,无法通过喷嘴可控地挤出并支撑印刷在其顶部的层的重量。通过添加气相二氧化硅纳米颗粒和SE 1700(图2b)可以实现所需的粘度增加。由无定形的二氧化硅制成的纳米粒子通过氢键彼此相互作用,形成疏松的网络,从而改变了弹性体的流变性。在最佳配方下,与纯Sylgard 184弹性体相比,低应变下墨水的复合粘度增加了100倍(从4至420 Pa)。与纯Sylgard 184不同,垫片墨水显示出剪切稀化行为(图2c),这是打印过程中可控且一致的流动的必要特征。最重要的是,垫片墨水在低应变速率下的损耗模量高于储存模量,表明它在静止时主要具有类似于液体的特性(图2d)。垫片墨水的这一特性使它在沉积后能够流动并均匀地覆盖母模上的特征(图2a中部)。
储能模量反应了材料的弹性也就是材料的刚性,储能模量越大,材料越不容易变形;损耗模量反应了材料的粘性也就是韧性。
隔室墨水为制造结构稳定的高长宽比的垂直特征而设计。 隔室墨水的基础是3D打印的合适材料即SE 1700弹性体。 在最终配方中添加Sylgard 184可以增强墨水的印刷性能,该墨水表现出剪切稀化行为,表明它适用于高精度的基于挤压的3D打印(图2c)。 与垫片墨水不同,隔室墨水在静止状态下以固体状为主,低应变时,其弹性模量(储能模量)高于损耗模量(图2d)。因此,一旦沉积墨水就保持其形状,从而保持隔室壁的结构完整性。
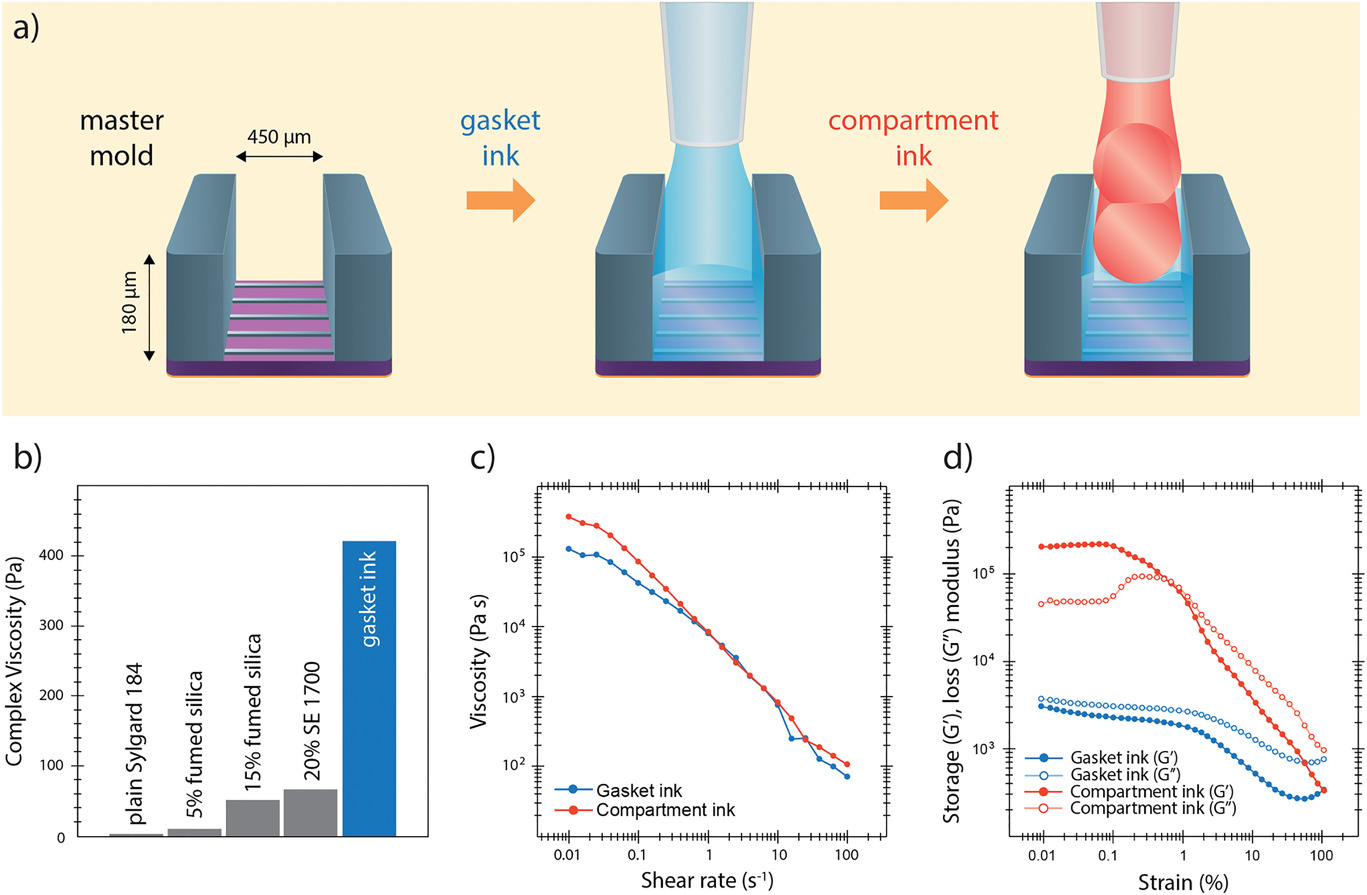
上图反映了墨水的流变性:
- a)插图显示了两种墨水在母模上的沉积(未按比例绘制)。流动的垫片墨水直接印刷在母模的顶部。墨水覆盖了微通道成型的小特征,但没有溢出标记隔室边界的高特征墙,从而形成了定义的垂直边缘。多层隔室墨水沉积在垫片的顶部,以制造隔室壁。
- b)当添加剂与Sylgard 184基地混合时,0.01%应变下的复合黏度随之增加。最终使用的垫片墨水包括15%的气相二氧化硅和20%的SE 1700。
- c)在稳态条件下,较高的剪切速率下粘度降低表明两种墨水的剪切稀化行为。
- d)在振荡扫描模式下,储能模量(G’)和损耗模量(G’’)是所施加应变幅度的函数。隔室的墨水经历了固液过渡过程,其应变约为1%。另一方面,垫片墨水在整个应变幅度范围内都以液体特性为主导。
为了探索3D打印软光刻的制造能力,我们接下来生成了几种具有任意复杂设计的分隔微流控设备:“脑”设备,同心圆设备和轴突横切设备(图3a)。 使用传统的软光刻技术无法制造这些设备,并且凸显了3D打印的软光刻技术在制造具有高纵横比的垂直隔室壁的多尺度特征方面的潜力。
作为第一个示例,我们制作了一个4×4 cm的分隔的“大脑”设备,在微观和宏观上均具有定义的结构元素(视频S1,本文略)。该设备的垫片类似于人头的轮廓,而用于神经元培养的五个隔室则类似于人脑的五个区域。 隔室中装有不同颜色的墨水,以证明它们之间的物理分离(图3b)。每个隔间都被封闭在5毫米高的壁内,从而可以将细胞体空间分隔。 墙壁是垂直的,宽度为450 µm,高度为5 mm(图3c)。这样高的纵横比(11: 1)是通过以200 µm喷嘴以隔室墨水单层宽度打印实现的。可以在墙壁的棱纹纹理中识别出各个层。 从图3d中可以看出,微通道是忠实复制于隔室壁底面上的模具。微通道高4.7 µm,宽8 µm,横跨连接两个相邻隔室的壁的整个宽度。
为了表明所制造设备的生物学适应性(图3e中部),人类神经干细胞(hNSCs)在隔室中分化,生成了一个覆盖了每个隔室底表面的密集的神经元网络(左图3e)。然后微通道允许神经突向外生长,连接“大脑”装置的不同区域(右图3e)。
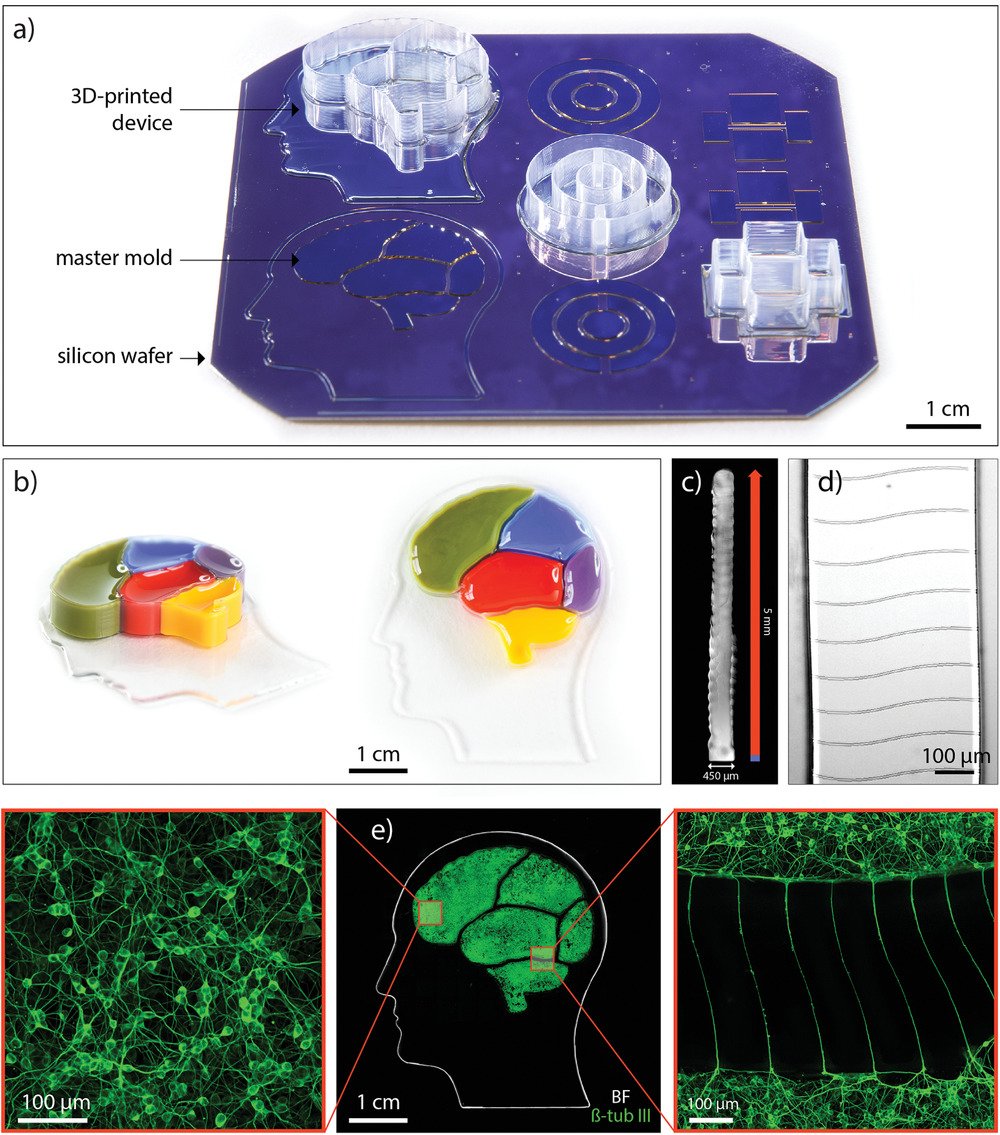
荧光图像标记为β-微管蛋白III(β‐tubulin III),这是一种几乎只在神经元中发现的微管元件。
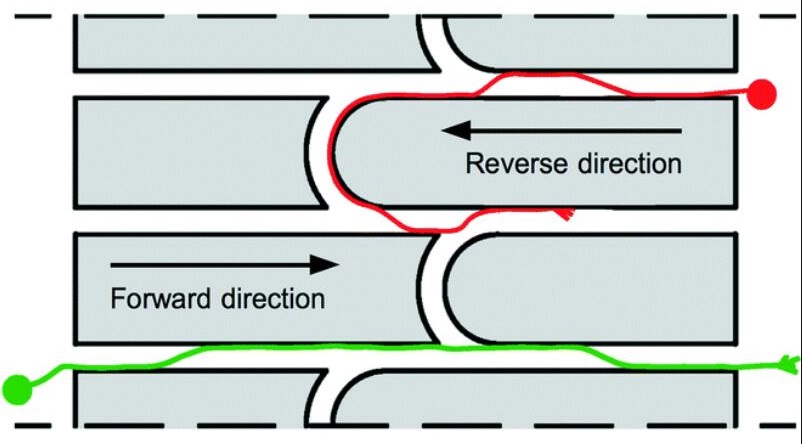
第二个设计证明了已开发方法的能力,即同心圆装置,旨在最大化隔室之间的微通道界面,并采用了“返回发件人”微通道设计,该设计已证明可诱导神经突向外生长( 图S1a–c)。[2]
参考文献2,该设计旨在引导神经元群之间的单向连接,当前已有几种主动方法如使用光、化学梯度、介电泳力等,但是这些方法一方面在时间和仪器上开销较大,同时要求刺激与轴突发育同步,使得实验平行化变得困难。另一种方法是使用被动方法如几何约束控制其生长方向。
如图所示,这种设计下,红色轴突会U形转向原方向室;绿色轴突则会正向生长。
第三种设计,即轴突切断设备,举例说明了3D打印的软光刻技术对于制造封闭的微流控通道的适用性。除了两个开放式隔室之外,该设备还包含一个封闭的微流控轴突隔室,可用于切断神经投射以研究轴突损伤和再生(图S1d–f)。

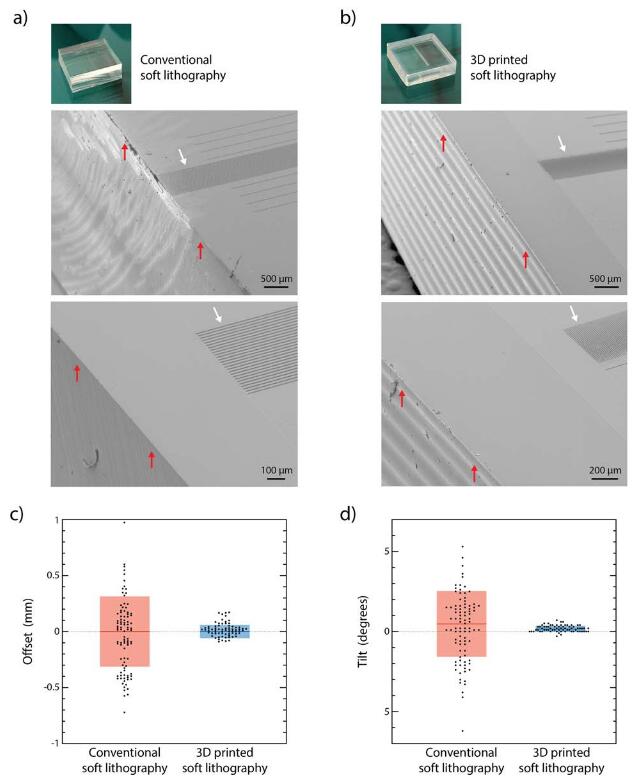
由于PDMS的沉积受到控制,因此无需对设备进行手动后处理(例如,用解剖刀或活检打孔器切割),这些设备可能会损坏微结构或产生不必要的悬突(图S2)。

印刷完成后,将制造的设备简单地在烤箱中固化,将其从母模上剥离下来,然后装在盖玻片上。3D打印的软光刻技术还可用于微接触印刷的压模的更精确和可复制的制造,其中微图案相对于压模外边界的定位是一个已知问题(图S3)。
Biocompatible Compartmentalized Devices for hNSC Differentiation
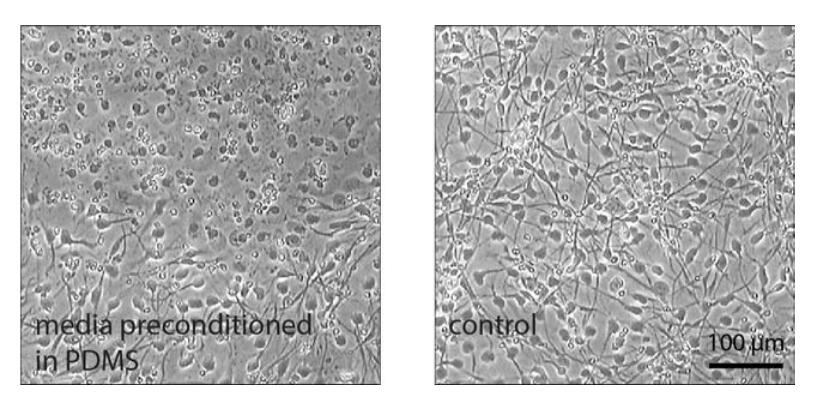
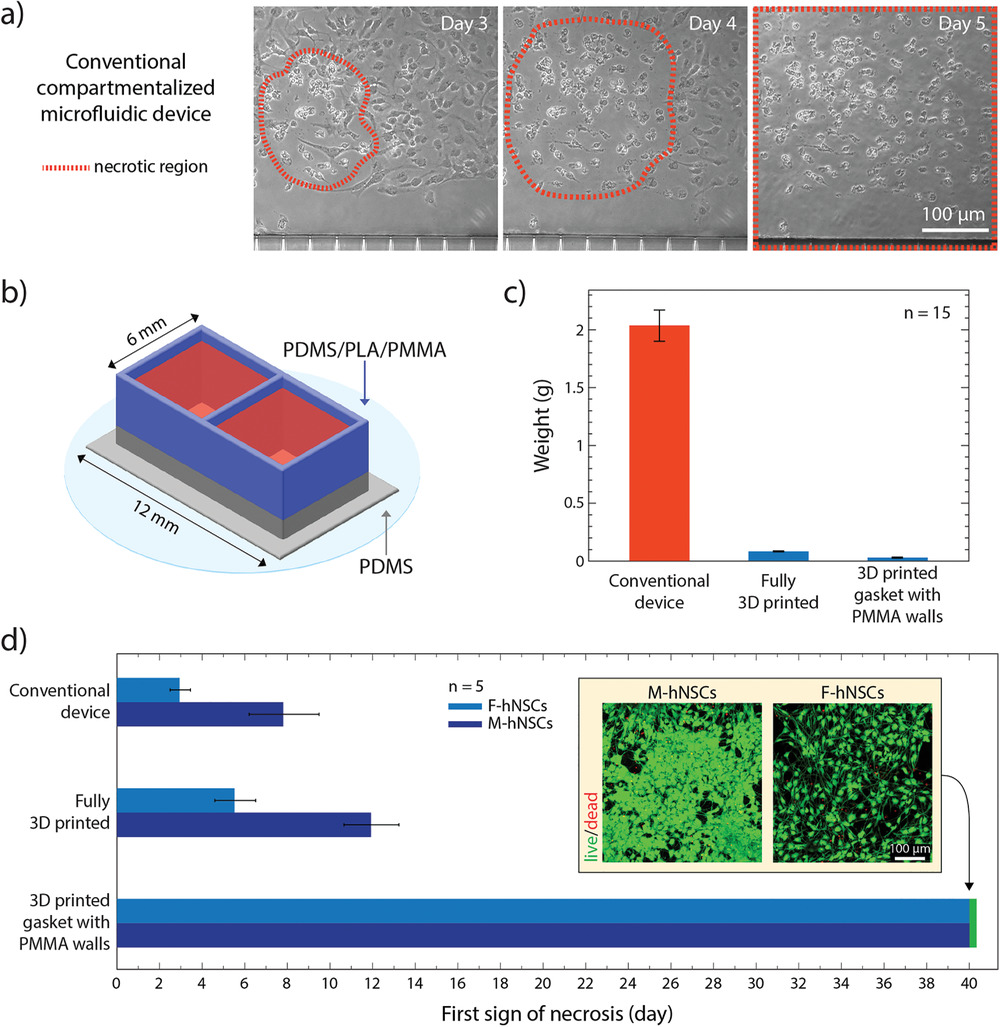
本研究中使用了两个不同的hNSC系。其中一种来自人类胚胎的前脑区域,下文称为F‐hNSC。第二种来源于中脑腹侧,称为M‐hNSC。当在常规孔板中分化时,F-hNSCs产生的细胞群中星形胶质细胞的百分比很高,而M-hNSCs则生成高百分比的多巴胺能神经元。我们使用基于PDMS的传统微流控分隔装置进行的初步实验证明对两种细胞系均具有不利影响(图4a)。在细胞分化的某一时刻,细胞死亡被观察到位于局部坏死核区,其大小逐渐增大并最终扩散到整个细胞群。F‐hNSCs对这一现象尤为敏感。从图4a中可以看出,这一现象最早在体外第3天就很明显。 几天之内,坏死在整个细胞群中扩散。因此从F-hNSCs产生星形胶质细胞是不可行的。我们利用F‐hNSCs对环境扰动的敏感性,作为可靠的读数来探索已开发设备的生物相容性。
首先,为了分离PDMS与微流控结构的影响,我们在XonaChips中对F-hNSCs和M-hNSCs进行分化,这是一种由环烯烃共聚物制成的商用注塑两室装置,与常规的分区式PDMS装置设计相同。[3]在该设备中,分化成功表明两种细胞系都与微流控环境兼容(图S4)。然而,当我们尝试使用PDMS孔中预处理的培养基在商用聚苯乙烯48孔板中区分F‐hNSCs时,在分化的第一周内出现了与常规PDMS装置中观察到的坏死模式相同的情况(图S5)。这些结果表明,PDMS本身而不是微流控环境会影响细胞。
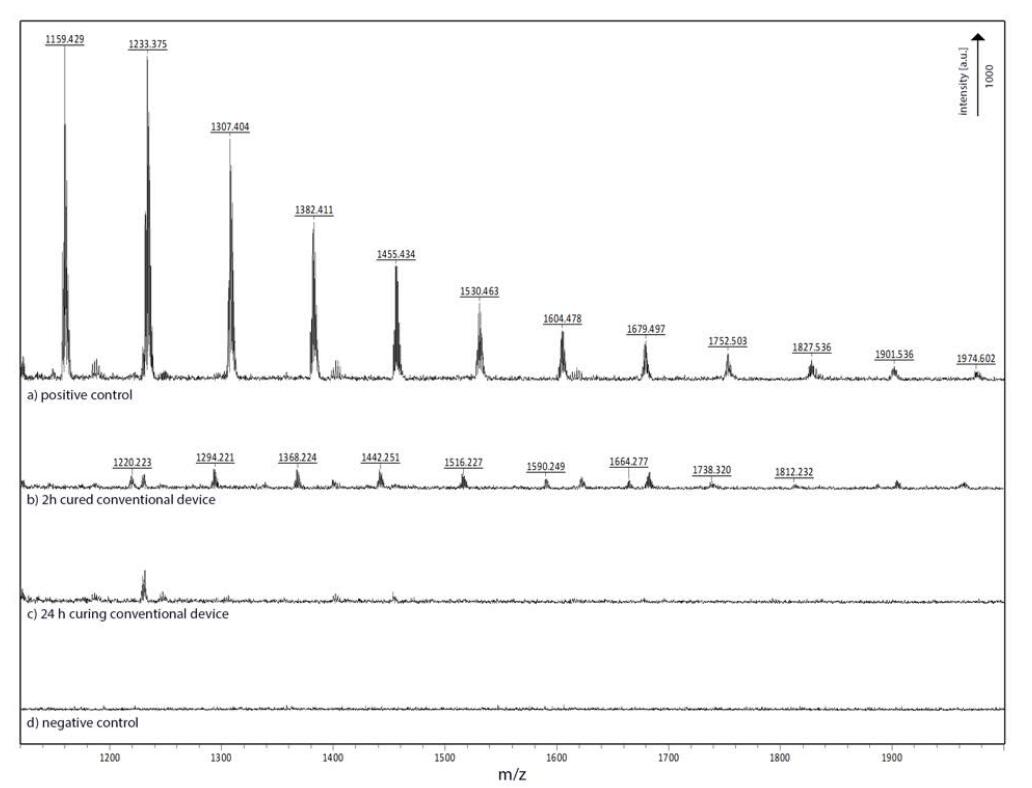
毒性的原因之一可能是存在未固化的PDMS低聚物,它们从设备壁中浸出并嵌入细胞膜中。据报道,增加固化时间和溶剂萃取未聚合的低聚物和用于固化弹性体的金属催化剂提高了材料的生物相容性。[4,5]在我们的案例中,溶剂萃取导致常规PDMS装置的重量减少了4.6±0.1%(n = 6),表明清除了大量未聚合的的低聚物。基质辅助激光解吸电离飞行时间(MALDI-TOF)分析浸出的PDMS含量显示,当固化时间为2 h时,常规装置的培养基中存在PDMS低聚物,而当固化时间延长到24 h时,则未检测到低聚物(图S6)。然而,在分化过程中,溶剂萃取和延长固化均不能显著提高F‐hNSC存活时间,这表明未聚合的弹性体残留可能会显著影响细胞存活率。此外,溶剂萃取是一个漫长而费力的过程,将装置的制造时间增加了一周以上,并带来了未经清洗的溶剂分子产生毒性作用的风险。
蛋白质和小分子的非特异性吸收是PDMS装置的另一个潜在缺陷,它可能影响细胞分化和存活。[6]弹性体网络的多孔性质允许吸收的分子扩散到本体聚合物中。[7]因此,细胞培养基的组成可以显著改变。 吸收是时间相关的,非线性的,并且在不同化合物之间是可变的。[8]因此,简单改变细胞培养基的组成不会解决该问题。
对于分子的非特异性吸收和未固化的弹性体浸出,其共同的限制因素是装置中总细胞培养基体积与PDMS总体积之间的比率。装置中的本体聚合物的量充当吸收的分子和未固化的低聚物的蓄水池,并影响在PDMS和细胞培养基之间建立的最终平衡浓度。影响达到平衡之前的时间的速率限制因素是暴露于细胞培养基的PDMS表面积。暴露的表面积决定了低聚物浸出和来自培养基的分子被吸收到装置主体中的速率。
我们假设装置中PDMS总量的大幅减少以及PDMS与培养基的体积比将消除毒性作用,并允许在与商用聚苯乙烯组织培养孔板相同的条件下培养和分化hNSC。我们充分利用3D打印软光刻技术去制作这些规格的装置。为此,我们设计了一个矩形装置,该装置具有两个开放式隔室和450 µm的薄壁(图4b)。该设备已被完全打印,为了进一步减少PDMS的量并展示3D打印方法如何与其他材料结合使用,先打印0.5毫米高的壁,然后使用微磨过的聚甲基丙烯酸甲酯(PMMA)或3D打印的聚乳酸(PLA)扩展隔室。传统的PDMS装置,完全用PDMS打印的装置和PMMA/PLA扩展的装置可以在图S7中看到。制作完成后,对装置进行称重(图4c)。与传统装置相比,完全打印的装置可减少PDMS的总量约20倍,而PMMA扩展装置可将PDMS含量减少60倍。对于传统装置,完全打印装置和PMMA扩展装置,计算出的细胞培养基体积与暴露于细胞的PDMS表面积之间的比率分别为0.09、1.5和15。这意味着,与传统装置相比,PMMA扩展装置中暴露的PDMS每单位表面积的培养基体积增加了170倍,这将极大地减少PDMS的吸收影响,并将任何未聚合的齐聚物稀释到有害阈值以下。的确,如图4d所示,装置中PDMS的总含量和暴露表面积的减少对分化过程中hNSC的存活有显著影响。全3D打印的装置比传统微流控设备有所改进(尽管不足以进行长期培养),但在具有PMMA扩展的装置中进行分化时,即使在培养40天后,两种细胞系均未显示出PDMS特异性坏死的任何迹象(图4d插图)。在这个时间点,实验已经停止,因为已经证明这些敏感细胞系具有增加的生物相容性。在此过程中,我们还考虑了基于苯乙烯-异戊二烯-苯乙烯(SIS)嵌段共聚物油墨的完全打印替代品。但是,与PMMA / PDMS混合装置相比,这些设计通常会与支撑物脱离,并且生物相容性较差。因此,选择了PMMA扩展的PDMS打印装置进行后续实验。

Generation of Functional Human Neurons and Astrocytes in 3D‐Printed Devices
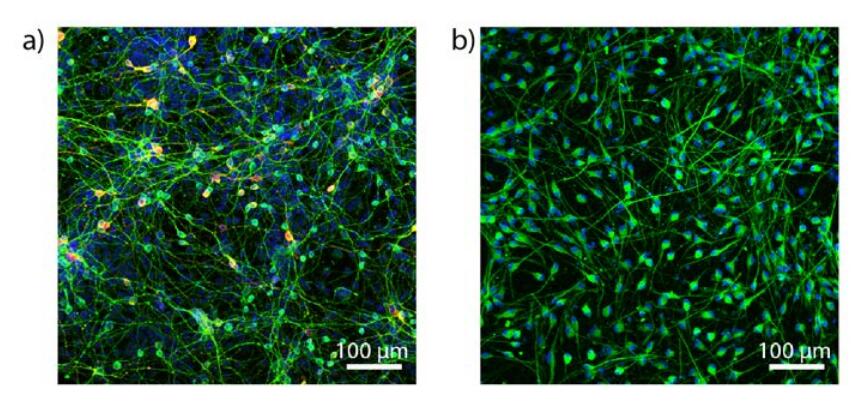
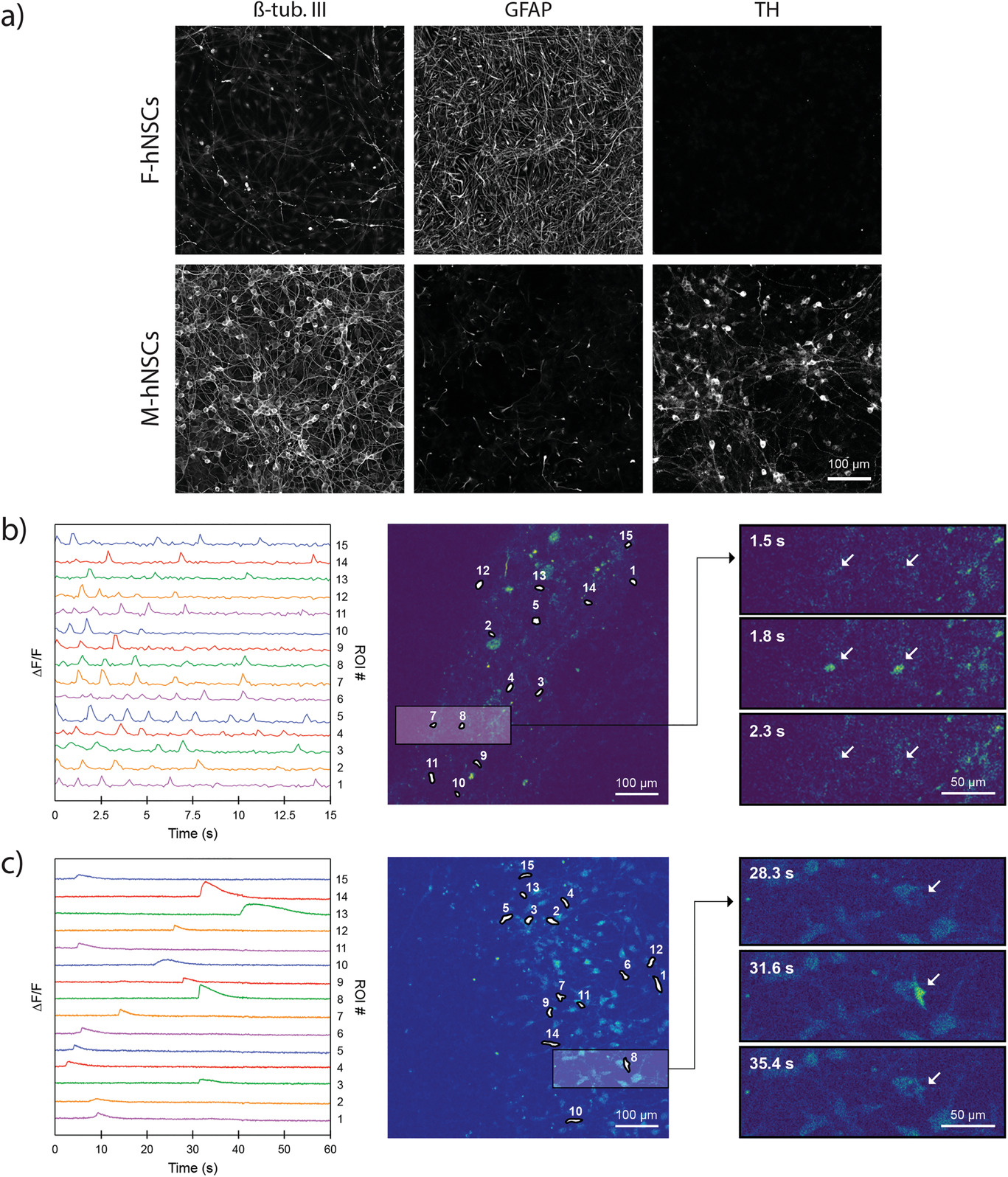
免疫细胞化学实验表明,在PMMA扩展的装置中hNSC分化是成功的,且不受环境因素的阻碍。图5a显示了在从M-hNSCs分化的细胞群中神经元标记物β-微管蛋白III的高表达,而在从F-hNSCs分化的细胞中则没有。另一方面,来自F‐hNSC的细胞富含GFAP,GFAP即胶质纤维酸性蛋白,是一种主要在星形胶质细胞中表达的中间丝蛋白。此外,酪氨酸羟化酶(TH)是多巴胺合成中的限速酶,存在于M-hNSC衍生的细胞中,不存在于F-hNSC衍生的细胞中。这些结果表明,我们的新系统能够使NSCs分化为富含星形细胞的F‐hNSCs细胞群和多巴胺能神经元的M‐hNSCs细胞群,这与之前发表的使用传统聚苯乙烯组织培养孔板的结果完全一致。此外,为了证明我们的装置并不仅仅与人类神经干细胞系兼容,我们在装置中从成人患者源性成纤维细胞中直接转化生成诱导神经元(iNs),并在无不良影响的情况下培养30天。
为了证明所产生的神经元和星形胶质细胞的功能活性,我们进行了钙成像。为了区分神经元和星形细胞的钙活性,采用了两种方法。在第一种方法中,我们表达了GCaMP3,这是MAP2启动子下方的一种遗传编码的钙标记物,目的是可视化神经元中细胞内钙的活性。如图5b所示,在M-hNSC产生的神经元群体中没有任何去极化刺激的情况下,记录了自发的钙瞬变。这是健康细胞群体的标志。瞬变表明单个电池具有多种尖峰行为,尖峰持续时间为100–300 ms,平均间隔为1.1±0.4 s(左图5b)。同样,由M-hNSC产生的神经元网络对化学刺激也有反应(视频S2,本文略)。相反,在由F-hNSC产生的富含星形胶质细胞的细胞群中未观察到钙活性。为了记录该种群中的活性,我们给细胞加载了一种非细胞类型特异性的膜可渗透性荧光Ca2 +指示剂。这次,在富含星形胶质细胞的人群中记录了自发的钙活性(左图5c)。在从5 s到超过15 s的指数衰减后,记录的Ca 2+达到峰值,平均延迟为0.96±0.58 s。 F-hNSC群体中Ca2 +瞬变的动力学与M-hNSC群体中的记录显着不同,并且类似于体内记录的Ca2 +瞬变的星形胶质足迹。 这些结果表明3D打印的软光刻技术可用于使微隔室设备与人干细胞分化为健康的功能神经元和星形胶质细胞兼容。
Reconstructing Directionality in the Nigrostriatal Pathway via Fast Prototyping of the Microscale Features
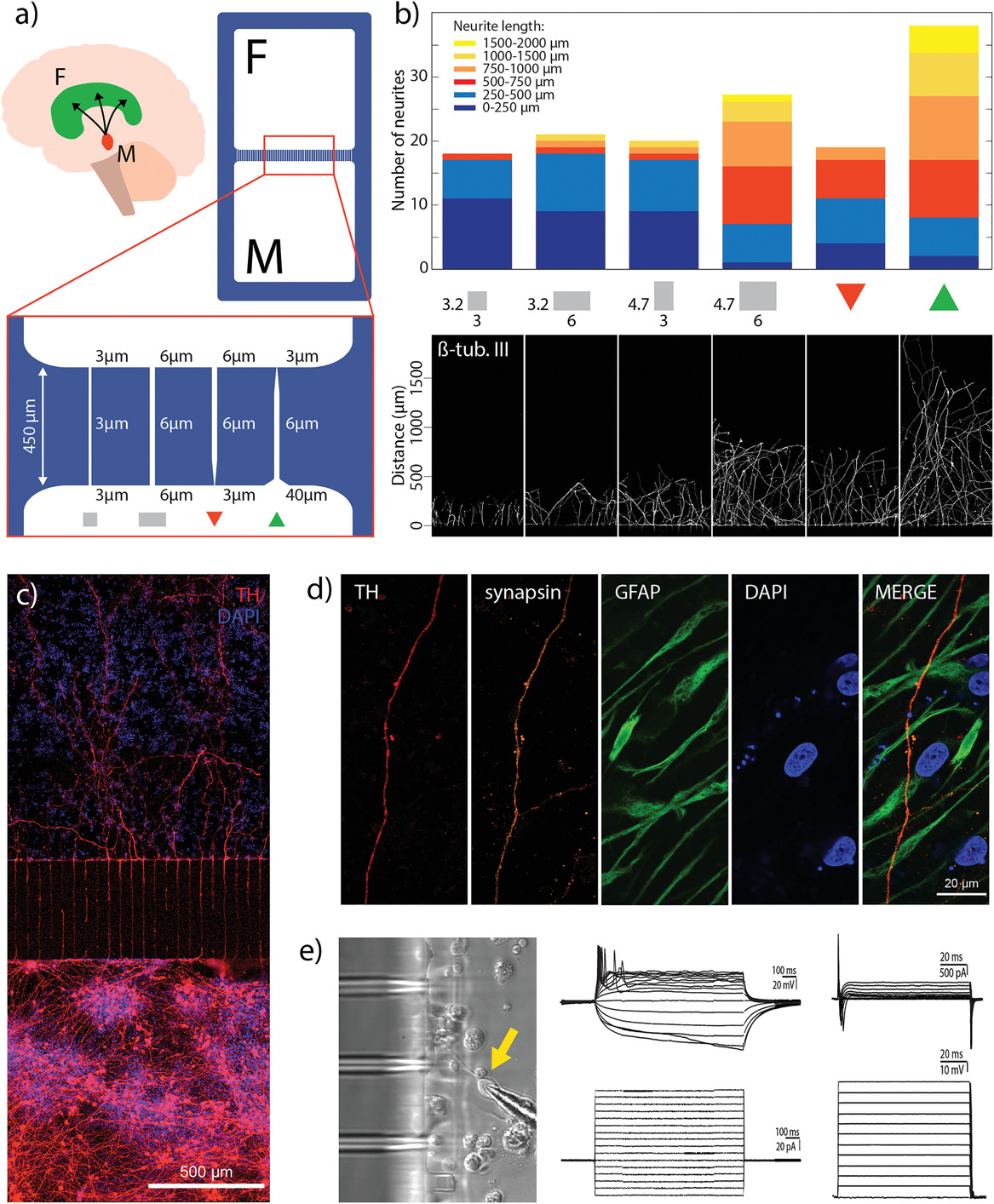
黑质纹状体途径是一种多巴胺能途径,连接了中脑的黑质致密部(SNpc)与前脑中的背侧纹状体(图6a)。这种多巴胺能连接是单向的,其中多巴胺能神经元从SNpc投射并将多巴胺传递到背侧纹状体。黑质纹状体途径中多巴胺能神经元的丧失是PD的标志。此外,越来越多的证据表明,星形胶质细胞可能在PD中扮演了起始致病作用的角色。已经发现,PD相关基因在星形胶质细胞中表达,其功能障碍可能导致神经元毒性。[9]这些发现表明星形胶质细胞在维持黑质纹状体途径中多巴胺能神经元的功能活性中可能是重要的。为了探索3D打印软光刻作为一种快速原型方法的功能,该方法可以通过工程化微通道研究神经突生长,我们在芯片上构建了黑纹状体途径的原理验证。我们利用上一节中的两室设备在空间上分离星形胶质细胞(代表前脑)和多巴胺能神经元(代表中脑),同时通过工程化微通道促进多巴胺能投射的定向生长。优化了微通道的结构,最大化突出到相邻隔室的多巴胺能轴突的数量和长度,同时防止沿相反方向的投射,以模仿体内情况。首先,测试了450 µm和900 µm两种长度的微通道。由于神经投射无法成功横越较长微通道的全长,因此在后续实验中,我们将微通道长度保持在450 µm。接下来,我们探索了微通道的设计如何影响由M-hNSC产生的轴突生长。尽管文献中已经报道了该领域的工作,但大多数是用原代鼠神经元进行的。重要的是,此处研究的人类多巴胺能神经元的生长动力学和发育途径是不同的。因此,在我们的研究中,我们不能直接应用已报道的为鼠细胞的设计。相反,我们通过更改以下参数筛选了24种不同的微通道设计:微通道高度,微通道入口的形状,微通道中间部分的宽度以及微通道出口的形状(图6a)。我们在一个隔室中分化了细胞,并观察到相反的空隔室中神经投射的生长。我们确定了六个设计,这些设计显示了微通道尺寸对M-hNSC衍生的神经投射的增长的影响(图6b)。无论通道的宽度如何,3.2 µm的高度都会阻碍其生长,只有12%的轴突延伸超过500 µm进入相邻隔室。将微通道高度增加到4.7 µm,但将宽度保持在3 µm并不能改善神经突的生长。但是,当微通道尺寸增加到6 µm的宽度和4.7 µm的高度时,我们观察到透射轴突的数量增加了150%,其中有75%的轴突延伸超过500 µm进入相邻隔室(图6b)。具有较大尺寸的微通道不能有效地防止细胞在隔室之间迁移。 最后,我们探讨了漏斗设计(也称为轴突二极管)对轴突传输的影响。在通道入口处加宽40 µm会增加神经突进入通道的可能性,而3 µm的收缩会产生相反的效果(图6a分别是红色和绿色三角形)。结果表明,当设计中包括大开口时,正在生长的轴突的数量及其长度都将最大化。 轴突突出到相邻隔室中多达2 mm(图6b绿色三角形)。值得注意的是,在另一组实验中,当针对F-hNSC(不沿黑质纹状体途径投射)对微通道设计进行筛选时,在相邻的隔室中没有观察到分化细胞的投射。
在优化微通道设计以生成定向神经网络后,我们分化了装置底部隔室中的M-hNSC和顶部隔室中的F-hNSC。图6c显示了分化20天后设备中生成的神经网络。 底部隔室富含多巴胺能神经元,其突出物延伸穿过微通道并支配相邻的细胞群。如所选微通道设计所预期的那样,多巴胺能突出物深入到相对的隔室深达2毫米。突触素在多巴胺能投射中表达,表明相邻隔室中存在突触小泡,这是隔室间功能神经元连接的关键成分(图6d)。在同一图中,可以观察到在传输的多巴胺能投射周围有星形胶质细胞网络。
除了用于显微镜的光学通道外,已开发设备的垂直壁薄还可以直接物理访问微通道附近的细胞,从而可以对工程的黑质纹状体途径中分化的hNSCs进行电生理全细胞膜片钳研究(图6e左)。通过使用微电极进行单细胞电生理学记录,我们靶向培养物中的神经元样细胞。通过监测被动膜的特性,我们发现细胞保留的静息膜电位范围为−30至–45 mV,表明细胞已成功分化为相关的神经元表型。在所有贴片细胞中,膜电阻(取决于膜中离子通道密度的值)相似。而且,由膜电容表示的细胞大小在贴片细胞之间相似。在电流钳模式下,将电流注入细胞,以检测细胞产生动作电位(AP)的能力(图6e中)。所有记录的细胞都显示了在商业组织培养皿中诱导的AP的存在。这些记录表明细胞通过膜去极化产生交流和产生电信号的能力。在电压钳模式下,我们检查了内向钠和外向钾电流的存在,以此来衡量电压门控的钠和钾通道的表达(右图6e)。 所有的细胞在膜上都显示出这样的电流。该数据证实细胞具有电生理活性,突出了已开发的装置用于建模和研究神经元交流的潜力。
电生理全细胞膜片钳研究:膜上离子的进出引起的电流或电压的改变,因为阴阳离子进出细胞膜,就会产生电流或改变膜电位。膜片钳主要就是就是将变化的电流流经记录电极,然后通过内部反馈电阻的放大器等效计算,最后被我们以对应电压或电流显示观察到。
上图是黑质纹状体途径的芯片上重建。
- a)黑质纹状体通路的图形表示,该通路单向连接中脑(M)的黑质致密部(SNpc)的多巴胺能神经元到前脑(F)的背侧纹状体;本节中使用的分区装置的图形表示不同的微通道设计的说明。
- b)图中显示了20个微通道阵列(n = 3)相邻隔间中传输轴突的数量和长度(上)和传输投射对应的荧光图像(下)。
- c)荧光图像显示了支配相对细胞群的相邻隔室中多巴胺能轴突的定向生长。
- d)荧光图像显示在星形胶质细胞包围的对侧隔室中透射的多巴胺能轴突。突触素与TH在相邻隔室中传输的轴突上共同表达,表明存在突触小泡。TH:酪氨酸羟化酶;synapsin:突触素;GFAP:胶质纤维酸性蛋白;DAPI:一种DNA染色剂。
- e)明场图像显示了微量移液器吸头进入微通道附近的细胞(左)全细胞膜片钳记录,显示了电流注入步骤(中下部)的多个诱导的动作电位(中上部)。 在电压钳研究中,当施加电压步进(右下)时,电池显示出存在内向钠和外向钾电流(右上)
生物电信号科普:生物电现象与临床
Discussion
本文提出的混合增材制造方法克服了一些基于块状PDMS浇铸的传统软光刻系统相关的一些限制。特别是它免除了手工切割隔室的需要,例如使用钝针或活检打孔器,不仅费力,并可能导致损坏或微结构错位。此外,我们的程序允许更广泛的装置设计,例如高纵横比的开放式隔室微流控系统。最近的一些报告提出了旨在克服与这种常规设备相关联的限制的替代方法。例如,一份报告将铸造PDMS与计算机数控(CNC)铣削和热压花相结合,以在PMMA主模具中创建所需的特征,而另一份报告则使用3D打印的钢制嵌件扩展了SU-8主模具中的特征。 与这些程序相比,此处介绍的3D打印的软光刻路线引入了一种简单、通用且可重现的工艺流程。同时,它还与常规软光刻中使用的基于SU-8光刻的标准化洁净室工艺制造的母模完全兼容。此外,3D打印的软光刻技术为使用其他与批量铸造不兼容的材料提供了一条微流控设备成型的途径。立体光刻技术是另一种越来越受欢迎的制造方法,用于生产高纵横比微流控设备,但其分辨率目前仅限于18µm微流体通道,因此不能用于神经科学应用以单微米级的设计变化创建神经突引导所需的微通道。[10]
除了扩展设计能力之外,我们的程序还通过限制功能性装置中PDMS的总量,允许利用PDMS的许多吸引人的材料特性,同时消除了与生物学应用相关的可能缺点。利用这一优势,我们能够创建隔室装置以用于人类干细胞源性神经元和星形胶质细胞的长期培养。值得注意的是,细胞表型和生存力都充分维持了至少40天。这表明,尽管PDMS的过量可能会对敏感的细胞培养造成损害,但我们可以减轻这些损害,以便长期培养和研究高度敏感的hNSCs。这项成就非常重要,因为目前为止人干细胞来源的神经元的长期培养(至少2周)只在少数几份报告中得到证明,而对更健壮、需要较短培养时间的原代小鼠神经元进行了大量研究。值得注意的是,我们的发现还表明弹性体(如苯乙烯-异戊二烯-苯乙烯嵌段共聚物油墨)在体外生物学中使用较少,但在我们的程序中可被视为PDMS的替代品,但并非没有问题。作为基于光刻装置的替代品,市售的注塑设备可能是敏感的神经元培养的合适解决方案。但是,此类设备的价格昂贵,并且无法提供3D打印软光刻必须具备的设计自由和快速原型制作能力。
最后,我们通过创建原理验证培养系统证明了该程序的通用,该系统使我们能够在设备中重建黑质纹状体通路。这是通过筛选微通道设计完成的,该设计可使hNSC衍生的中脑神经元的多巴胺能投射最大化。研究结果表明,在用人体细胞进行探索性研究时快速原型设计和设计灵活性的重要性。微米范围内微通道形状和尺寸的变化对投射的生长有显著影响,进一步表明在制造过程中保持完整的微观结构的重要性。所开发的系统表明,3D打印软光刻允许设计的灵活性覆盖单微米到厘米范围,允许设备适应特定用途和特定细胞类型。我们只演示了星形胶质细胞在多巴胺能神经元保护中的作用这一可研究的场景。可能的替代方法是用GABA能神经元替代星形胶质细胞,以研究其信号传播,该神经元在体内受到多巴胺能神经元的活性抑制。 还可以设计一个系统来研究α-突触核蛋白聚集体的传输,这是PD的一种常见病理。从更大角度来看,我们的方法和干细胞技术,直接重编程技术和基因编辑技术在神经科学领域为研究神经疾病、神经网络形成和体外测试药物开辟了许多机会。
α-突触核蛋白是帕金森病的发病机制中最重要的蛋白,因为它是路易小体的主要结构成分,α-突触核蛋白聚集与路易小体的形成及多巴胺能神经元的死亡密切相关。
生理状态突触核蛋白包括包括α-突触核蛋白(α-syn)、β-突触核蛋白(β-syn)和γ- 突触核蛋白(γ-syn)三种类型。α-突触核蛋白单体由三部分组成:(1)氨基端:4个不完全重复序列的区域,是家族性PD基因突变的好发部位;(2)羧基端: 35个氨基酸残基序列,包含两个不完全重复的序列,具有很强的β折叠趋向,这些趋向是某些位点突变后造成突触核蛋白单体之间聚集的重要原因。(3)NAC:区富含带负电荷的酸性氨基酸,可以和重金属结合发生聚集。
α-突触核蛋白在各种因素的影响下异常表达和聚集,这一过程产生的氧化应激等生化反应和寡聚体中间构像等均在帕金森发病过程中起着重要的作用。生理状态的α-突触核蛋白为无序单体,病理状态的突触核蛋白为聚合状态,即毒性α-突触核蛋白。
Conclusion
总而言之,我们展示了一种用于软光刻的增材制造方法,该方法可以简单地制造具有垂直壁并可以控制微观和宏观特征的开放式隔室装置。与传统的软光刻相比,我们的方法扩展了设计的可能性,克服了由手动后处理引起的不精确和损坏的问题,并增加了系统的生物相容性。利用开发的方法的优势,我们创建了隔室装置,以支持将敏感的hNSCs分化为健康的神经元和星形胶质细胞并长期维持。此外,我们设计了黑质纹状体途径的体外原理验证模型。 我们的方法依赖于负担得起的商业材料、传统的光刻技术和3D打印技术,这是许多研究机构越来越普遍的一部分。由于其简单性,通用性和可访问性,3D打印的软光刻技术有可能成为制造微流控装置的常用解决方案。
Experimental Section
Device Design and Master Mold Fabrication
设备元件是在Adobe Illustrator中设计的,并在Tanner L-Edit软件中进行了进一步处理。有热生长的氧化硅的硅晶片被用作母模的衬底。作为第一层的用于微通道成型的图案是使用SU-8光刻(用于4.7 µm高的微通道)或反应离子刻蚀(用于3.2 µm高的微通道)制造的。然后使用SU-8光刻技术制造第二个180 µm的高厚度层,用于模制隔室。
图案化4.7 µm高的微通道模具——将SU-8 2005以5000 rpm的速度在RCD8 T旋涂机(Süss MicroTec)上旋涂60 s,以获得4.7 µm厚的层。 然后将晶片在热板上于90°C软烘烤3分钟。微通道图案是由无掩模对准器(MLA100, Heidelberg Instruments)制作的。曝光后,在90℃下烘烤3分钟。然后在含有显影剂mr‐Dev 600的专用槽中进行10分钟的显影。晶圆用异丙醇彻底冲洗。
图案化3.2 µm高的微通道模具——旋涂1.5 µm负性抗蚀剂(nLOF 2020),并在110°C下烘烤以用作蚀刻掩模。使用无掩模对准器将微通道图案曝光。 晶片在曝光后于110°C烘烤并显影。 随后在110°C进行硬烘烤,以允许任何溶剂蒸发并硬化抗蚀剂以进行干法蚀刻。首先使用氟化物在先进的氧化物刻蚀机(STS MESC Multiplex ICP)中完全蚀刻氧化硅层。随后进行1分钟的硅蚀刻,以将微通道图案的深度定义为3.2 µm。然后在氧气中剥离抗蚀剂掩模。
图案化180 µm高的隔室模具——将180 µm厚的SU-8 2075抗蚀剂层旋涂,然后在50°C的温度下进行6小时的软烘烤。 然后使用无掩模对准器曝光隔室图案。 曝光后在50°C下进行6 h烘烤,以使暴露的SU-8结构交联。 然后像以前一样将晶圆显影20分钟,然后在异丙醇中彻底冲洗。 最后,在90°C下进行15小时的硬烘烤。
然后使用1H, 1H, 2H, 2H-全氟癸基三氯硅烷(FDTS)对母模进行表面改性,以促进从模具中去除固化的PDMS。利用针形轮廓仪和光学显微镜对结构的高度和保真度进行了验证。最后,晶片被切成小块,以便在打印阶段更好地贴合和对齐。
Ink Formulation, 3D Printing, and Device Assembly
为了制造垫片墨水储备,将气相二氧化硅纳米颗粒(平均粒径200-300 nm,Sigma-Aldrich)逐渐添加到Sylgard 184弹性体(Dow Corning)中,直到气相二氧化硅含量达到15%。一次将约1 g的纳米颗粒添加到弹性体中,并在双旋转混合器(SpeedMixer, Hauschild)中以2500 rpm的速度混合1分钟。重复该过程直至达到所需的浓度。将混合物静置过夜并再次混合以达到均匀质材质,该材质作为储备用于以下步骤。为了制造垫片墨水,在含15%气相二氧化硅的Sylgard 184中添加20%Dowsil SE 1700(Dow Corning)。为了制造隔室墨水,Dowsil SE 1700添加了10%的Sylgard 184。弹性体的相应交联剂以10:1的比例添加。
将墨水在双旋转混合器中以2700 rpm的速度混合30 s,然后装入5 cc注射器筒中。为了除去气泡,将注射器在1700 G下离心3分钟。然后用塑料锥形针(内径200 µm)盖住注射器,然后将其装入3D生物打印机(regenHU)。使用真空抽吸将包含母模的硅晶片固定在打印阶段。在BioCad软件(regenHU)中定义了基于母版制造的设计的打印路径。室温下通过气动挤出直接在硅片上进行印刷,其中垫片墨水在550 Pa的压力下挤出,隔室墨水在275 Pa的空气压力下挤出。两种墨水的喷嘴速度均设置为10 mm s-1。垫片墨水以150 µm的层高打印,而隔室墨水以190 µm的层高打印。对于具有PMMA或PLA扩展的装置,只打印了三层隔室墨水,以便存在用于附着纤维的平坦表面。打印后,将包含打印装置的硅晶片放入60°C的烘箱中2天以完全固化硅弹性体。PLA扩展是使用透明的PLA丝在Felix Pro 3 3D打印机(Felix Robotics)上打印的。使用1.5毫米立铣刀在5 mm厚的PMMA薄板中微磨PMMA延伸部分。通过施加一个薄层PDMS弹性体并在60°C下将装置固化过夜,将延伸部分连接到基座上。 固化结束后,将单个器件从硅片上剥离下来,并在96%乙醇中灭菌。 通过暴露于空气等离子体将每个装置共价结合到玻璃盖玻片上。作为接种细胞之前的最后一步,将隔室与Geltrex基质(ThermoFisher Scientific)在磷酸盐缓冲液(PBS)中以1:100稀释液在37°C孵育过夜,以促进细胞粘附至玻璃表面。 使用D7200相机(尼康)拍摄了打印过程以及最终设备的视频和照片。 墙壁横截面和微通道设计的明场图像是在Primovert倒置宽视野显微镜(Zeiss)上拍摄的。
Rheology
墨水的流变学特性的表征是在配备有25 mm平行板几何形状的Discovery HR-2流变仪(TA Instruments)上进行的。在25°C下对新鲜混合的墨水进行测量。 对范围为0.01%至100%的应变值进行1 Hz的振荡幅度扫描。同样的振幅扫描用于获得在0.01%应变下的复合粘度值。在0.01和100 s-1之间变化的剪切速率下,获得了稳态流曲线。
MALDI–TOF Oligomer Detection
每个条件(2小时固化时间和24小时固化时间)准备了15个常规装置。装置中的每个微流控通道都充满10 µL超纯水,并在37°C下温育72小时。将所有通道的内容物汇集在一起,冻干,然后重悬在甲苯中。将蒽三酚基质(Dithranol),样品和三氟乙酸银按10:5:1的比例混合,并在MALDI-TOF质谱仪(Autoflex Speed,Bruker)上进行分析。甲苯中的PDMS被用作参考样品。
常用基质及选择
基质 样品 HCCA 蛋白,多肽,糖,小分子,极性聚合物 DHB 蛋白,多肽,糖,小分子,极性聚合物 HPA 核苷酸 Dithranol 非极性聚合物 IAA 非极性聚合物
hNSC Culture and Differentiation
本研究中使用的两种hNSC系均按照之前所述培养。hNSCs在解冻后至少培养两代,然后接种到包覆的多隔室装置上。细胞被播种在之前用于维持其生长的相同培养基中,称为生长培养基。该生长培养基的基础是DMEM/F12(ThermoFisher Scientific)和GlutaMAX(ThermoFisher Scientific)。此外,培养基中还包含6 g L-1葡萄糖(Sigma Aldrich),5×10-3 m HEPES缓冲液(ThermoFisher Scientific),0.5%w / v AlbuMAX牛血清蛋白(ThermoFisher Scientific),各40×10-6 m 的l-丙氨酸(Merck Millipore)、l-天冬酰胺一水合物(Merck Millipore)、l-天冬氨酸(MerckMillipore)、l-谷氨酰胺酸(Merck Millipore)和l-脯氨酸(Merck Millipore),100倍稀释的N-2添加剂(ThermoFisher Scientific),青霉素/ 链霉素混合物,表皮生长因子(EGF)和成纤维细胞生长因子(FGF)(R&D Systems)各20 ng L-1。
播种后24小时,将生长培养基替换为分化培养基。使用与生长培养基相同的成分制备分化培养基,但将EGF和FGF替换为1×10-3 m 二丁酰腺苷3’,5’-环一磷酸钠(Sigma Aldrich)和2 ng L-1 胶质细胞源性神经营养因子 (GDNF)( PeproTech)。48小时后,将分化培养基完全替换为新鲜的分化培养基。 然后,每隔两天用新鲜的分化培养基替换2/3分化培养基,直到实验结束。
Generation of Induced Neurons from Fibroblasts
成人皮肤成纤维细胞是在患者知情同意下从约翰·范·盖斯特脑修复中心(Cambridge, UK)的帕金森氏病研究诊所获得的,并在当地伦理许可下使用(REC 09 / H0311 / 88)。这项研究中使用的细胞系来自两名健康的67岁和70岁女性皮肤采样。
重编程方案使用了表达Ascl1,Brn2的开放阅读框(ORF)的DNA质粒,以及针对miR-9 / 9 *和miR-124的miRNA环,以及靶向REST的shRNA。使用的慢病毒是第三代载体,其包含非调节性遍布的磷酸甘油酸激酶(PGK)启动子。 在最终的MOI值为20时使用了这些载体。本研究中使用的所有病毒的滴度在3×108和6×109 pfu mL-1之间。
在铺板之前,将孔用聚鸟氨酸(15 µg mL-1),纤连蛋白(0.5 ng µL-1)和层粘连蛋白(5 µg mL-1)(PFL)的混合物包被过夜。成纤维细胞以27 800个细胞cm-2的密度接种。病毒转导后三天,将成纤维细胞培养基替换为神经分化培养基(NDiff227,Takara-Clontech),并补充以下浓度的生长因子:LM-22A4(2×10-6 m,R&D Systems),GDNF(2 ng mL-1,R&D Systems),NT3(10 ng µL-1,R&D Systems)以及db-cAMP(0.5×10-3 m,Sigma)和小分子CHIR99021(2×10-6 m, Axon),SB‐431542(10×10-6 m,Axon),noggin(0.5 µg mL-1,R&D Systems),LDN‐193189(0.5×10-6 m,Axon),丙戊酸钠(VPA, 1×10-3 m,Merck Millipore)。在转换的前30天中,每两天进行一半培养基更换,而在转换的后期,每三天进行一次培养基更换。 转导后第18天,不再给小分子,仅在神经元培养基中补充了LM-22A4,GDNF,NT3和db-cAMP,直到实验结束。
Whole Cell Patch‐Clamp Recording
细胞移至记录室,并根据记录的标准程序浸入23℃含95% O2和5% CO2的流动人工脑脊液(ACSF)溶液中。ACSF的成分为:126×10-3 m NaCl,2.5×10-3 m KCl,1.2×10-3 m NaH2PO4-H2O,1.3×10-3 m MgCl2-6H2O,2.4×10-3 m CaCl2 -6H2O,22×10-3 m NaHCO3,10×10-3 m葡萄糖。将溶液的pH调节至7.4。使用Multi-clamp 700B(Molecular Devices)进行记录,并使用pClamp10软件和数据采集单元(Digidata 1440A,Molecular Devices)以10 kHz的频率采集信号。在整个实验过程中监控输入电阻和注入电流。用硼硅酸盐玻璃移液器(4–7MΩ)将以下细胞内溶液填充:122.5×10-3 m葡萄糖酸钾,12.5×10-3 m KCl,0.2×10-3 m EGTA,10×10-3 m HEPES,2×10-3 m MgATP,0.3×10-3 m Na3GTP和8 mv NaCl。 用KOH将溶液的pH调节至7.3。在电流钳模式下插入后,立即监测静息膜电位。 在整个记录中监测膜电容,如果观察到值变化超过30%,则将其丢弃。膜电位保持在- 60 ~ - 70mv之间,注入的电流为- 20 ~ + 90pa,增量为10pa,以诱导AP。在电压钳模式下,在10mv去极化步骤中测量向内的钠和延迟整流钾电流。
Calcium Imaging—GCamP3
使用pM2.G和PMDLg将MAP2-GCamP3慢病毒报告质粒(Addgene Plasmid 43917)包装在HEK-293T细胞中。这些实验使用的慢病毒滴度在3×108和6×109 pfu mL-1之间。 在培养的第18天以MOI 5将病毒添加到培养基中,以确保可检测到的荧光水平。孵育24小时后,进行了总培养基更换,转导后24–48小时出现了用于分析的荧光神经元。
Calcium Imaging—Fluo3 AM
将细胞与3×10-6 m Fluo3 AM钙指示剂(ThermoFisher Scientific)在37°C下于含有0.02%Pluronic F-127(Sigma Aldrich)的细胞培养基中孵育30分钟。 然后将细胞在细胞培养基中冲洗,并在成像前于37°C孵育30分钟。
包含MAP2-GCamP3报告基因和装有Fluo3AM的细胞的神经元的钙成像以相同的方式进行,如下所示。用100 µL包含1.2×10-3 m MgCl2、2×10-3 m CaCl2、150×10-3 m NaCl,5×10-3 m KCl,5×10-3 m 葡萄糖 ,以及10×10-3 m HEPES的基线缓冲液替换细胞培养基。成像是在配备有CSU‐W1旋转圆盘系统(Yokogawa),sCMOS相机(Teledyne Photometrics)和20倍物镜的倒置Ti2显微镜(Nikon)上进行的。在成像过程中,使用环境控制室将温度保持在37°C,并将CO2水平保持在5%。 暴露时间设置为30和100 ms,具体取决于钙瞬变的动力学。首先,记录自发活动。 最后,通过注入50 µL含有1.2×10-3 m MgCl2、2×10-3 m CaCl2、5×10-3 m NaCl、450×10-3 m KCl、5×10-3 m 葡萄糖和10×10-3 m HEPES缓冲液诱导细胞膜去极化来记录刺激的钙内流。在ImageJ(NIH)中分析图像并在QtiPlot中绘制。
Immunocytochemistry and Live/Dead Staining
在实验终点,将细胞用4%低聚甲醛固定并使用标准方案和以下抗体染色:β-微管蛋白III(小鼠,Sigma Aldrich T8660,1:1000)、TH(兔,PelFreez Biologicals P40101,1:1000) 、GFAP(兔,Dako Z0334,1:1000;小鼠,BiolegendSM121,1:500),突触蛋白(兔,Invitrogen 72732524,1:2000)。 对于荧光染色,Alexa 546(山羊抗小鼠,Thermofisher Scientific A‐11030,1:500),Alexa 647(山羊抗兔,ThermoFisher Scientific A‐21245,1:500),Cy5(驴抗兔,Jackson Immunoresearch,711605152,1:500)。 细胞核用DAPI(4’,6-二脒基-2-苯基吲哚)(1:1000)或2 µg mL-1 Hoechst 33342复染色。
37°C下,在2×10-6 m的Calcein AM(钙黄绿素)(Sigma Aldrich)和2×10-6 m的Ethidium homodimer-1(溴乙啡锭二聚体1)(EthD-1,ThermoFisher)中孵育细胞30分钟来进行死活细胞染色。
死活细胞染色原理是Calcein AM进入细胞,和活细胞中的酶反应形成Calcein荧光分子,并保留在细胞内部,所以通过Calcein荧光分子来检测活细胞;而EthD-1不能透过活细胞膜,只能进入死细胞和细胞内的基因片段结合后出现荧光,故此检测死细胞。Calcein AM和EthD-1没和细胞接触前不发荧光 。
图4d中的中间图像是使用上述Ti2显微镜的4倍物镜5×5 cm平铺扫描并通过在线图像拼接获取的。 其余图像在LSM 710(Carl Zeiss)倒置共聚焦显微镜上使用10倍、20倍和60倍放大率的物镜采集。 在ImageJ软件中对图像进行处理和分析。
Scanning Electron Microscopy
将样品安装在25 mm的铝制短管上,用10 nm铂/钯(80:20)进行溅射镀膜,并在Jeol JSM-7800F扫描电子显微镜中成像。
Statistical Analysis
Microsoft Excel和QtiPlot用于对该工作中显示的数据进行统计分析。 预处理和数据表示按以下方式进行。图2c,d显示平均值±SD。 图5b,c中的数据表示为从所选感兴趣区域到初始值的总荧光强度的时间序列。 图6b中的数据显示在与带有细胞体的隔室相邻的隔室中计数的神经突总数。 颜色编码表示分为六个类别的神经突的长度。 支持信息中图S3c中的数据进行了零均值归一化,并表示为均值±SD,并显示了各个数据点。 支持信息中的图S3d显示了平均值±SD,并显示了各个数据点。 样品大小在相应的图中注明。
Reference
[1] Kajtez J, Buchmann S, Vasudevan S, et al. 3D-Printed Soft Lithography for Complex Compartmentalized Microfluidic Neural Devices[J]. Advanced Science, 2020, 7(16): 2001150.
[2] Renault R, Durand J B, Viovy J L, et al. Asymmetric axonal edge guidance: a new paradigm for building oriented neuronal networks[J]. Lab Chip, 2016, 16(12): 2188-91.
[3] Paranjape S R, Nagendran T, Poole V, et al. Compartmentalization of Human Stem Cell-Derived Neurons within Pre-Assembled Plastic Microfluidic Chips[J]. Jove-Journal of Visualized Experiments, 2019(147).
[4] Regehr K J, Domenech M, Koepsel J T, et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture[J]. Lab Chip, 2009, 9(15): 2132-9.
[5] Millet L J, Stewart M E, Sweedler J V, et al. Microfluidic devices for culturing primary mammalian neurons at low densities[J]. Lab on a Chip, 2007, 7(8): 987-994.
[6] Szydzik C, Brazilek R J, Nesbitt W S. A Review of Design Considerations for Hemocompatibility within Microfluidic Systems[J]. Seminars in Thrombosis and Hemostasis, 2020, 46(05): 622-636.
[7] Toepke M W, Beebe D J. PDMS absorption of small molecules and consequences in microfluidic applications[J]. Lab Chip, 2006, 6(12): 1484-6.
[8] Van Meer B J, De Vries H, Firth K S A, et al. Small molecule absorption by PDMS in the context of drug response bioassays[J]. Biochem Biophys Res Commun, 2017, 482(2): 323-328.
[9] Booth H D E, Hirst W D, Wade-Martins R. The Role of Astrocyte Dysfunction in Parkinson’s Disease Pathogenesis[J]. Trends Neurosci, 2017, 40(6): 358-370.
[10] Gong H, Bickham B P, Woolley A T, et al. Custom 3D printer and resin for 18 mum x 20 mum microfluidic flow channels[J]. Lab Chip, 2017, 17(17): 2899-2909.