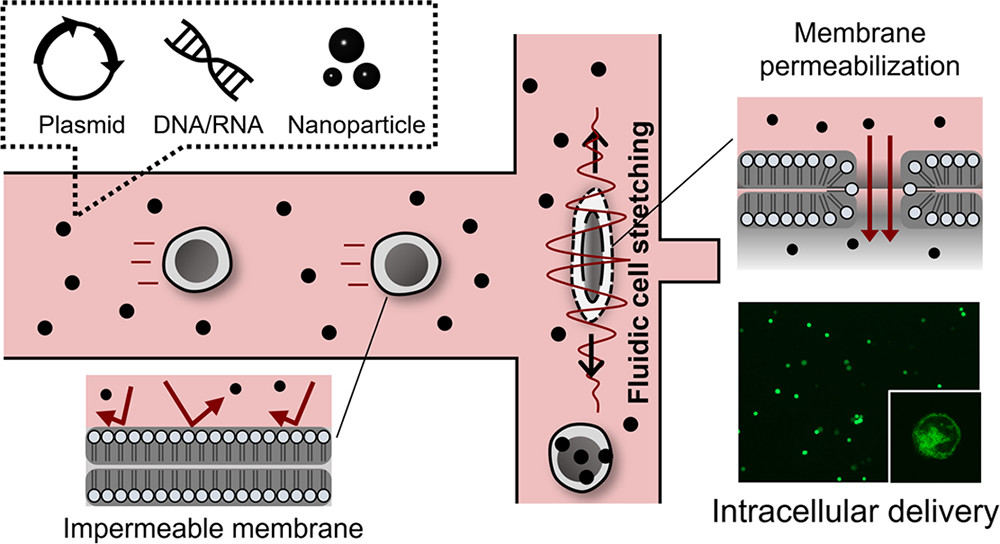
一种利用带有小洞的T型微通道产生的内在惯性力,通道里延伸的循环流将细胞拉伸,使细胞膜产生中断,由此可以高效内化DNA质粒、mRNA、SiRNA等。
Introduction
近年来,治疗范例正迅速从分子向基因和细胞治疗转移。细胞治疗十分依赖于基因纳米材料的设计,比如蛋白质,mRNA,DNA质粒和CRISPR-Cas9/纳米功能颗粒。为了最大化治疗效率,必须在亚细胞水平上以高特异性和完整性将复杂设计的外源纳米材料递送到作用部位的靶细胞中。
当前外源纳米材料通过载体被内化入细胞,例如病毒和脂质体,或者通过物理扰乱细胞膜。例如:
- 核酸转染广泛采用病毒载体。尽管病毒转染具有很高的递送效率,但这一过程代价高昂、耗时费力,常常导致不期望的基因组表达(即基因毒性)、细胞增殖延迟或不良免疫反应(即免疫原性风险),表明存在明显的安全问题。此外,病毒的限制性包装能力是病毒方法的另一个关键限制。
- 作为非病毒载体,脂质体和聚合物也通常用于递送外源生物分子。例如,阳离子脂质体(即脂质体转染)通过利用自然的胞吞过程有较高的细胞活性。然而,已被报道有显著的弱点包括解包延迟或失败(即内体包埋)和悬浮细胞的无效转染。
- 细胞膜破坏法的主要优势在于它们通过产生间断,具有在几乎所有类型的细胞中递送各种外来物质的能力。电转染是其中的代表。其递送原则是通过高电能穿过细胞膜的应用,产生外来物质的入口。在不同细胞系中有相对较高的递送效率,然而高电压的操作环境会导致实质性的细胞死亡因为细胞膜修复失败或较长时间的凋亡反应。另外的缺点是细胞功能的丢失或减少以及外来生物分子如蛋白质(如蛋白变性)和核酸在高电场下的的低生物稳定性。
本研究展示了一个通用的细胞内递送平台,利用带有小洞的T型微通道产生的内在惯性力,通道里延伸的循环流将细胞拉伸,使细胞膜产生中断。
Trypan blue assay
即台盼蓝检测。是利用正常的健康细胞能够排斥台盼蓝,而丧失细胞膜完整性的细胞可以被台盼蓝染色研制而成。严格来说,台盼蓝染色检测的是细胞膜的完整性,通常认为细胞膜丧失完整性,即可认为细胞已经死亡。
MTT assay
MTT是一种粉末状化学试剂,全称为3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di- phenytetrazoliumromide,汉语化学名为 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,商品名:噻唑蓝 。是一种黄颜色的染料。
检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO )能溶解细胞中的甲瓒,用酶标仪在490nm波长处测定其光吸收值,在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。根据测得的吸光度值(OD值),来判断活细胞数量,OD值越大,细胞活性越强(如果是测药物毒性,则表示药物毒性越小)。
Figure 1. Fluidic cell stretching platform design and delivery characterization
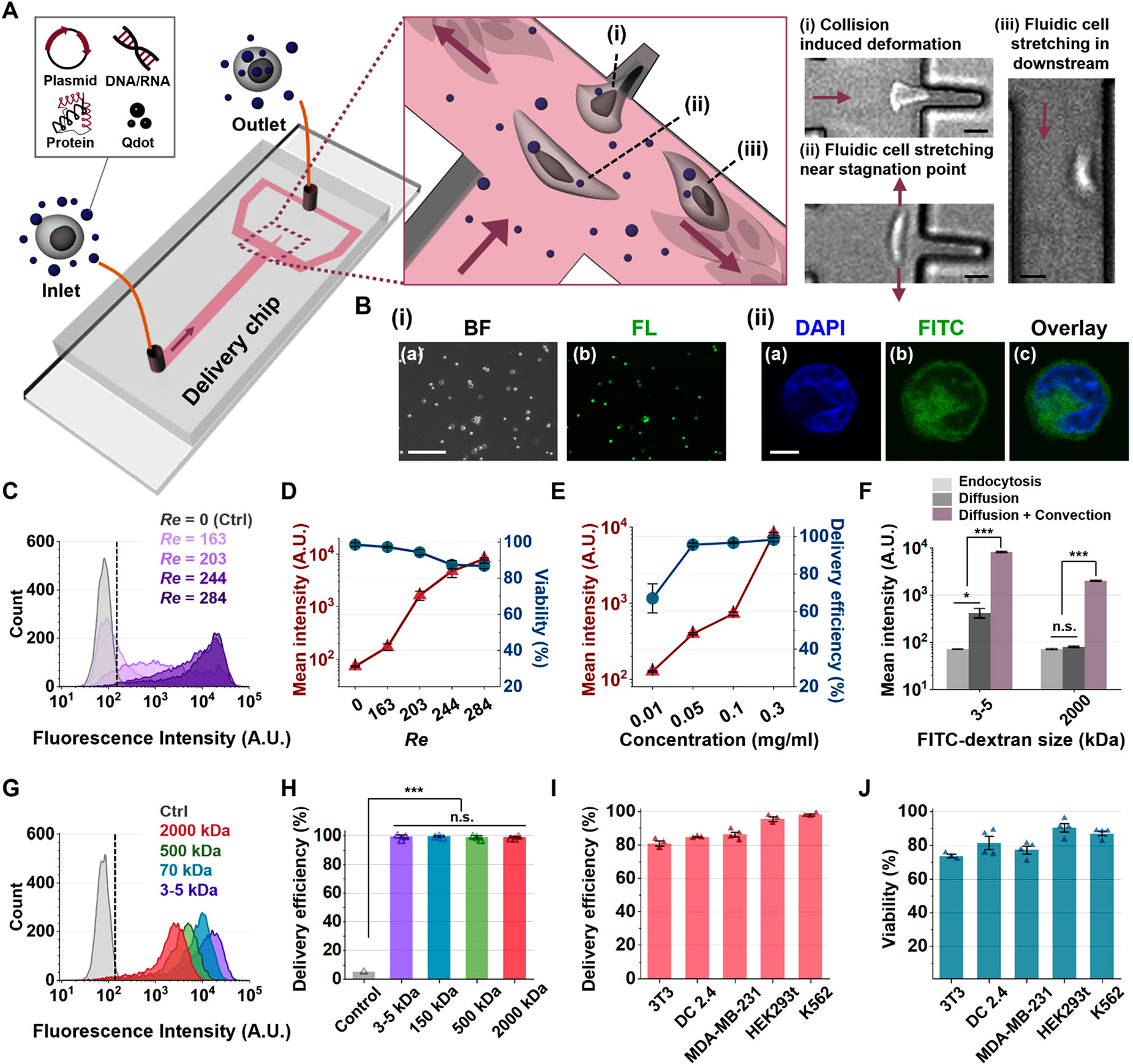
(A)平台递送过程的示意图。高速显微图像显示了细胞变形。
- (i)细胞轻微穿过小洞,碰撞形变。
- (ii)细胞由于局部扩展流场而被大幅拉长。
- (iii)向下游迁徙时,细胞承担了额外的射流细胞延长。
(B)
- (i)通过射流细胞拉升的3-5 kDa的FITC-葡聚糖递送进人白血病K562细胞的明场和荧光图像。
- (ii)DAPI(染细胞核)和FITC通道的K562细胞的共聚焦图像。
(C)不同Re值下(Ncell=5000/样)3-5 kDa的FITC-葡聚糖递送进K562细胞的荧光强度直方图。Re越大,柱状图向右偏移,表明荧光更强更均匀,即完成了更高等级的递送。
(D)3-5 kDa的FITC-葡聚糖递送进人白血病K562细胞的平均荧光强度和细胞生存与Re的函数关系。尽管细胞生存稍微减少,依然保持了高的细胞生存水平。
(E)3-5 kDa的FITC-葡聚糖递送进人白血病K562细胞的平均荧光强度和细胞生存与FITC-葡聚糖浓度的函数关系。
(F)通过不同机制(内吞、扩散、扩散+对流)递送的3-5和2000 kDa FITC-葡聚糖的平均荧光强度。2000 kDa FITC-葡聚糖可能由于斯托克阻力以及相对较小的不连续细胞膜,从而不允许较大的葡聚糖通过渗透作用进入。
(G)不同kDa的FITC-葡聚糖递送进K562细胞的荧光强度直方图。证明了本方法适用于较大物质进入细胞。
(H)不同kDa的FITC-葡聚糖递送进K562细胞的递送效率。
(I)2000 kDa FITC-葡聚糖在不同细胞系中的递送效率。
(J)2000 kDa FITC-葡聚糖在不同细胞系中的细胞生存。
射流
指流体从管口、孔口、狭缝射出,或靠机械推动,并同周围流体掺混的一股流体流动。经常遇到的大雷诺数射流一般是无固壁约束的自由湍流。这种湍性射流通过边界上活跃的湍流混合将周围流体卷吸进来而不断扩大,并流向下游。
Figure 2. Experimental and numerical investigation of inertial flow and corresponding cell stretching in a T-junction microchannel with a cavity

- (A)高速显微镜图像显示了射流细胞拉长。箭头代表主要流向。
- (i)停滞点的局部扩展流场导致细胞拉长。
- (ii)下游的拉长。在停滞附近,随着流动方向的变化,首先形成径向压力梯度。由于粘性耗散,压力梯度会沿出口方向衰减,并产生相反的的压力梯度,从而产生循环流,这构成了观察到的延长的细胞伸长。
- (B)停滞点和下游的形变指数与Re的函数关系。
- (C)流体流线评估。
- (i)使用COMSOL Multiphysics进行建模计算不同Re(从斯托克斯阻力到惯性状态)下的流体流线。
- (ii)实验结果和模拟结果十分吻合。
- (D)Re=407时的数字模拟的流线代表旋涡破裂,并解释了第二次细胞伸长现象。
- (E)数值预测了下游方向的压力等值线。
- (F)用4.8 μm的绿色荧光聚苯乙烯微球,对微粒子的捕获进行了实验验证的可视化。
在流场中每一点上都与速度矢量相切的曲线称为流线。流线是同一时刻不同流体质点所组成的曲线,它给出该时刻不同流体质点的速度方向。
旋涡破裂指在一定条件下,旋涡结构突然发生显著变化:在旋涡轴线的某些位置处出现流动滞止以及随之而来轴线附近流面的偏转,在某些流动情形下还有可能形成局部回流区。
Figure 3. Intracellular delivery of nucleic acid for genomic editing

(A)明场和荧光图像显示24小时后通过胞吞作用和细胞拉伸组K562细胞的EGFP mRNA表达。
(B)转染效率和mRNA浓度的函数关系。
(C)平均荧光强度和mRNA浓度的函数关系。
(D)明场和荧光图像显示人胚胎肾细胞HEK293t的GFP质粒DNA转染表达。
(E)转染效率和质粒DNA浓度的函数关系。与mRNA不同,质粒DNA必须先通过细胞膜,然后通过核孔进入核膜,这使得质粒DNA的递送具有很大的挑战性。此外,裸质粒DNA容易被核酸酶降解,粘稠拥挤的细胞质环境不利于长的、超螺旋的质粒DNA单纯通过扩散到达细胞核。
(F)平均荧光强度和质粒DNA浓度的函数关系。
(G)Western blot分析利用脂质体转染和细胞拉伸进行siRNA转染HeLa细胞的ITGA1基因敲减。
(H)HeLa细胞ITGA1基因的相对表达。
Figure 4. mRNA delivery into hard-to-transfect primary stem and immune cells using Lipofectamine 3000, electroporator, and the fluidic cell stretching
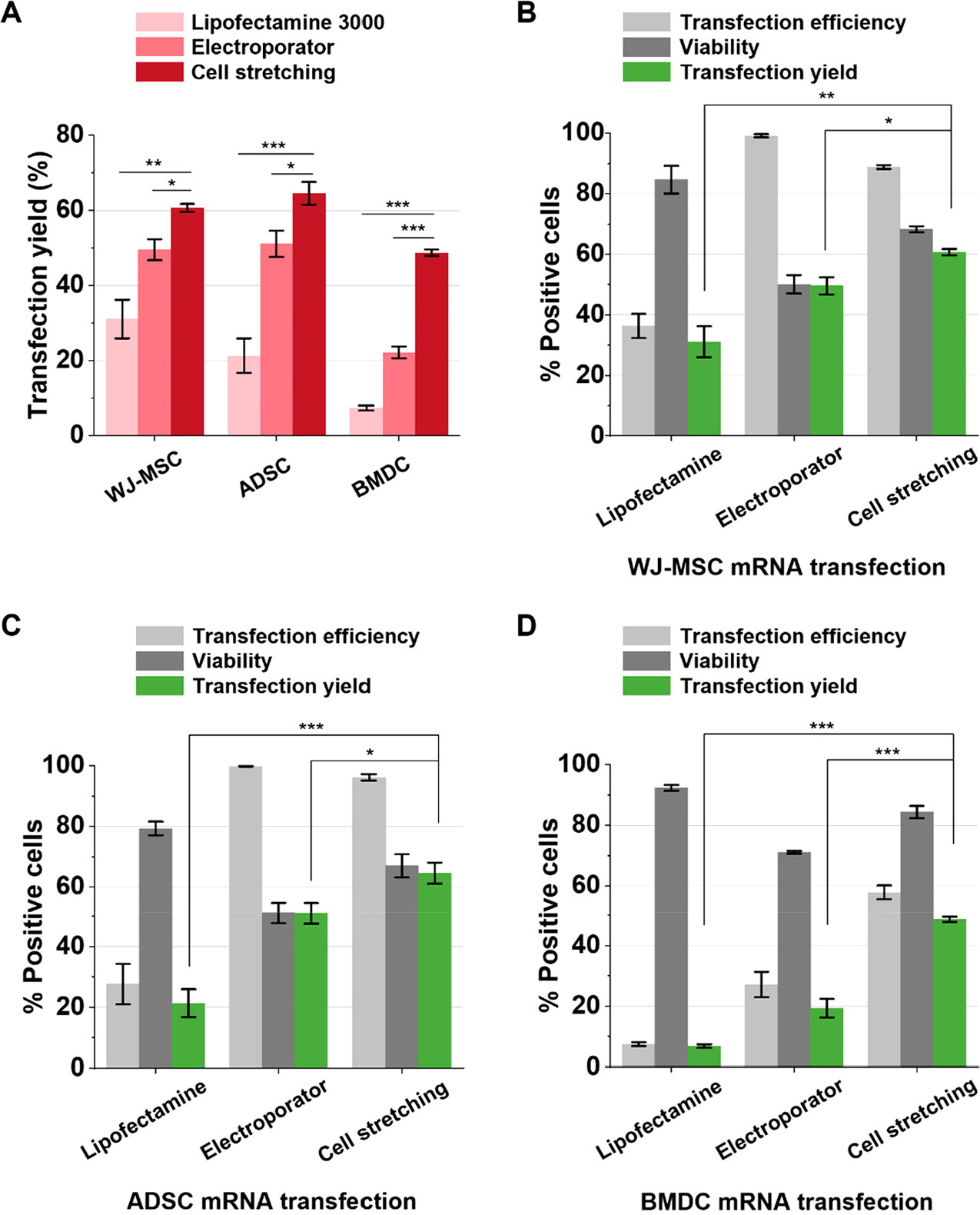
三种原代细胞(人脐带沃顿胶间充质干细胞WJ-MSC、脂肪干细胞ADSC、骨髓来源的树突状细胞BMDC)mRNA转染收益率(存活的转染细胞/处理过的细胞)。
B-D为分别比较三种细胞的转染效率、细胞存活率和转染产量。
Figure 5. Intracellular nanoparticle delivery via fluidic cell stretching
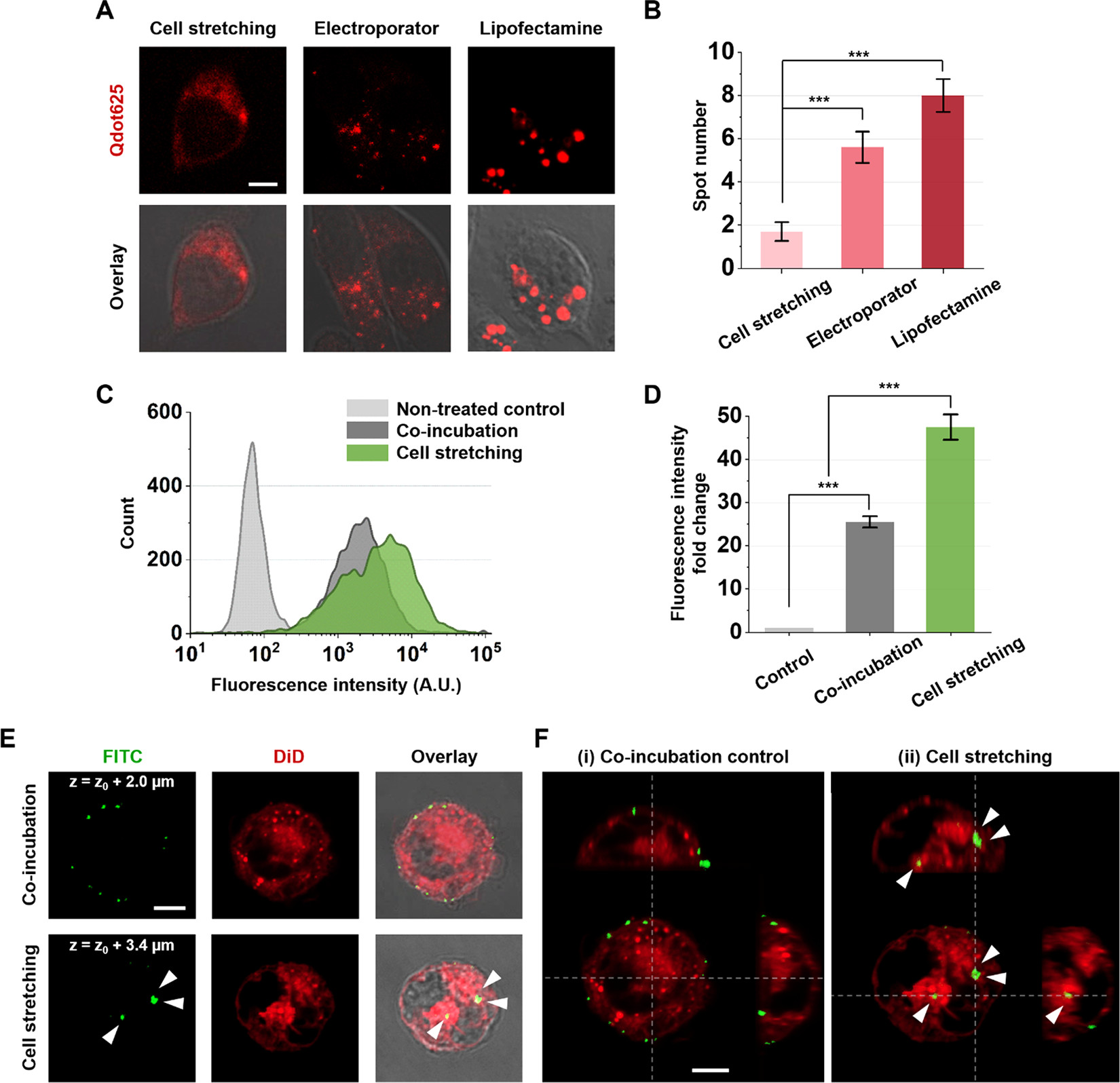
(A)量子点(Qdot625)通过细胞拉伸、电穿孔和脂质体法递进人乳腺癌细胞(MDA-MB-231)的共聚焦显微镜图像。
(B)Qdot625的点计数,表示聚合的点。应当避免量子点的聚集,以免它们不能到达细胞器靶点。显示了细胞拉伸方法可以实现较好的均匀分散。
(C)为了验证细胞拉伸方法适用于大尺寸的纳米球,因此设计了2个Control组,一个是未处理组,另一个是共孵育组。共孵育组是将K562细胞和纳米球在培养基孵育与拉伸过程相同的时间。然后进行荧光计数。
(D)三个组的平均荧光强度。可能是在共孵育组中,纳米球粘附在细胞表面。
(E)通过FITC和DiD通道,共孵育阳性对照和细胞拉伸组的代表性共聚焦图像与亮场叠加。
(F)共孵育阳性对照和细胞拉伸样本,使用FITC和DiD通道在z深度的正交投影共聚焦图像。可以看出,只有细胞拉伸方法可以把纳米球递送进细胞质。
DiD亲脂性羰花青染色
DiI, DiO, DiD, DiR是一系列亲脂性的荧光染料,可以用来染细胞膜和其它脂溶性生物结构。这些环境敏感性荧光染料在进入细胞膜之前荧光非常弱,当与细胞膜结合后其荧光强度大大增强。且具有消光系数高、极性依赖性、激发态寿命短等特点。一旦进入细胞膜后,可在整个细胞膜上扩散,最佳浓度时可以使整个细胞膜染色。
Conclusion
细胞内递送是细胞工程和细胞治疗的大范围应用中不可缺少的一步。本研究中提出了一个通用的微流控细胞内递送平台,能够高效的运输多种生物分子(葡聚糖、mRNA、SiRNA,质粒DNA、量子点)进难以转染的原代细胞。
Reference
Hur J, Park I, Lim K M, et al. Microfluidic Cell Stretching for Highly Effective Gene Delivery into Hard-to-Transfect Primary Cells[J]. ACS Nano, 2020.