
一种基于粘附性的肿瘤干细胞分离方法。
Introduction
精确分离和更好理解肿瘤干细胞(CSCs)在基础和临床研究中十分重要。也是在发展新颖治疗策略的关键因素。目前的CSCs分离方法主要依赖于CSC特异性细胞表面标志物或长期培养,然而CSC特异性细胞表面标志物在许多癌症类型中仍然不清楚,无标签的CSC富集方法可能能够取代基于生物标志物的分离,并广泛适用于不同的癌症类型。有报道称,分离出的CSC群体倾向于重新表达所有原有的一般标记,并在培养数天后逆转为混合群体。癌细胞可能会随机转变表型。鉴于在获得和维持CSCs的挑战,一个高效,快速,方便的CSC富集方法是可取的。
一些研究已经揭示了角质形成细胞和人乳腺上皮细胞的粘附性和干性之间的关系。由于CSC是具有正常干细胞特征的癌细胞,作者将细胞粘附性作为生物物理标记,制作CSC分离工具。
Figure 1. Schematic illustration
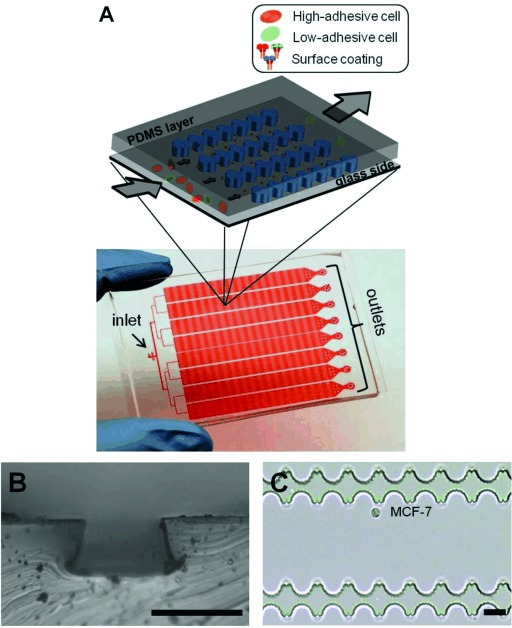
- (A)高通量细胞粘附芯片(HCA-Chip)的示意图和照片。芯片用红色染料填充。
- (B)HCA-Chip的光学显微图像,微通道深度约为25 μm。
- (C)微通道结构和捕获的MCF‐7细胞的光学显微图像。
Figure 2. Characterization of the HCA-Chip cell-capture yield for cancer cells in a buffer solution
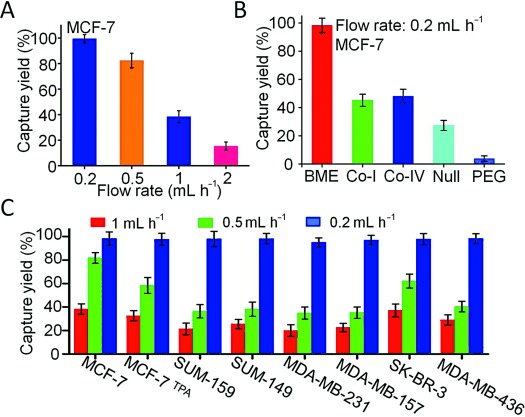
- (A)MCF-7捕获效率依赖于流速。
- (B)MCF-7在覆盖不同生物材料的HCA-CHips的捕获。
- (C)不同细胞系在覆盖BME的HCA-Chip的不同流速的捕获效率比较。
Figure 3. Analysis of the subpopulations of separated cells
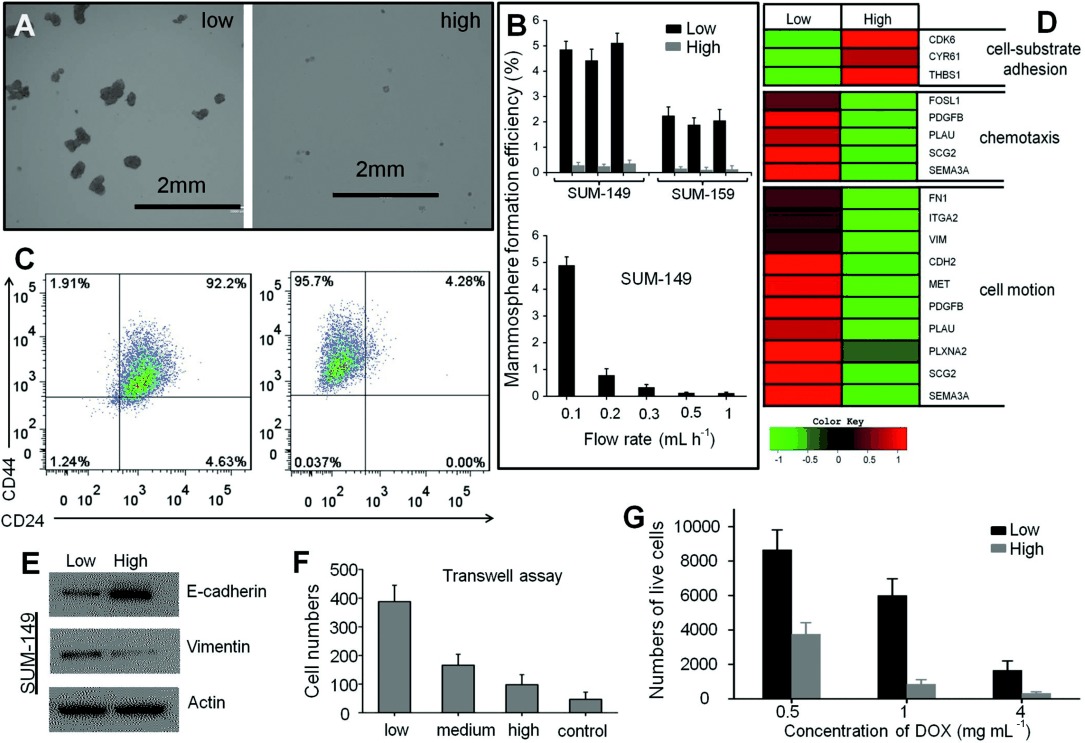
- (A)来自高/低粘附性的SUM-149细胞的乳腺球。
- (B)高/低粘附性亚群的乳腺球形成效率。
- (C)HCA-Chip分离前后SUM-149细胞中CD44/CD24表达的散点图。
- (D)热图显示低粘性和高粘性细胞中与细胞-基质粘附、趋化性和细胞运动相关基因的表达水平。
- (E)Western blot分析显示上皮细胞钙粘蛋白(E-cadherin)和波形蛋白(vimentin)的产生。
- (F)低粘性细胞具有较高的侵袭能力。
- (G)低粘性和高粘性细胞对不同浓度的阿霉素(DOX)的抵抗力。
Figure 4. Low-adhesive B16 melanoma cells demonstrated increased potential to induce tumor development

- (A)用高、中、低粘性B16细胞转移试验的肺部代表图像。
- (B-D)用高、中、低粘附性B16细胞植入的B6小鼠的肿瘤灶数量和肺部细胞总数,以及肺部重量。
- (E)用流式细胞仪分析不同粘附能力的B16细胞亚群中CD133、CD24和CD44的表达情况(红色:分选后;蓝色:未分选)。
Conclusion
综上,作者利用细胞粘附性作为生物物理标记,制作了一个CSC分离的工具。
Reference
Zhang Y, Wu M, Han X, et al. High-Throughput, Label-Free Isolation of Cancer Stem Cells on the Basis of Cell Adhesion Capacity[J]. Angewandte Chemie International Edition, 2015, 54(37): 10838–10842.



