
一种具有上下两层结构的新型模块化微流控芯片系统,实现体外构建大规模可灌注的微血管网络。
Introduction
血液循环系统包括一个封闭的血管网络,使血液在体内循环以进行气体交换和养分运输,这对于维持器官的生存至关重要。构建具有生物功能的人工组织和器官具有重要的意义。由于组织需要距离毛细管不超过200 μm,才能通过扩散获得营养,微血管网络在维持组织的生物学功能中起着重要作用。因此,微血管网络对于在体外构建大型、三维功能化的人工组织必不可少。同时,为了在体外模拟人体器官的特征和功能,更好地研究这些过程并了解潜在的生物学机制,需要构建大规模且可灌注的体外微血管网络。
本文提出了一种具有多层配置的模块化微流控芯片系统,通过将组织腔和培养液通道分离,实现了高密度的组织腔室结构,并在其中构建了覆盖面积超过14 mm2,血管密度为12 mm/mm2的大规模微血管网络。
Fig. 1 The modular microfluidic system combining two PDMS layers
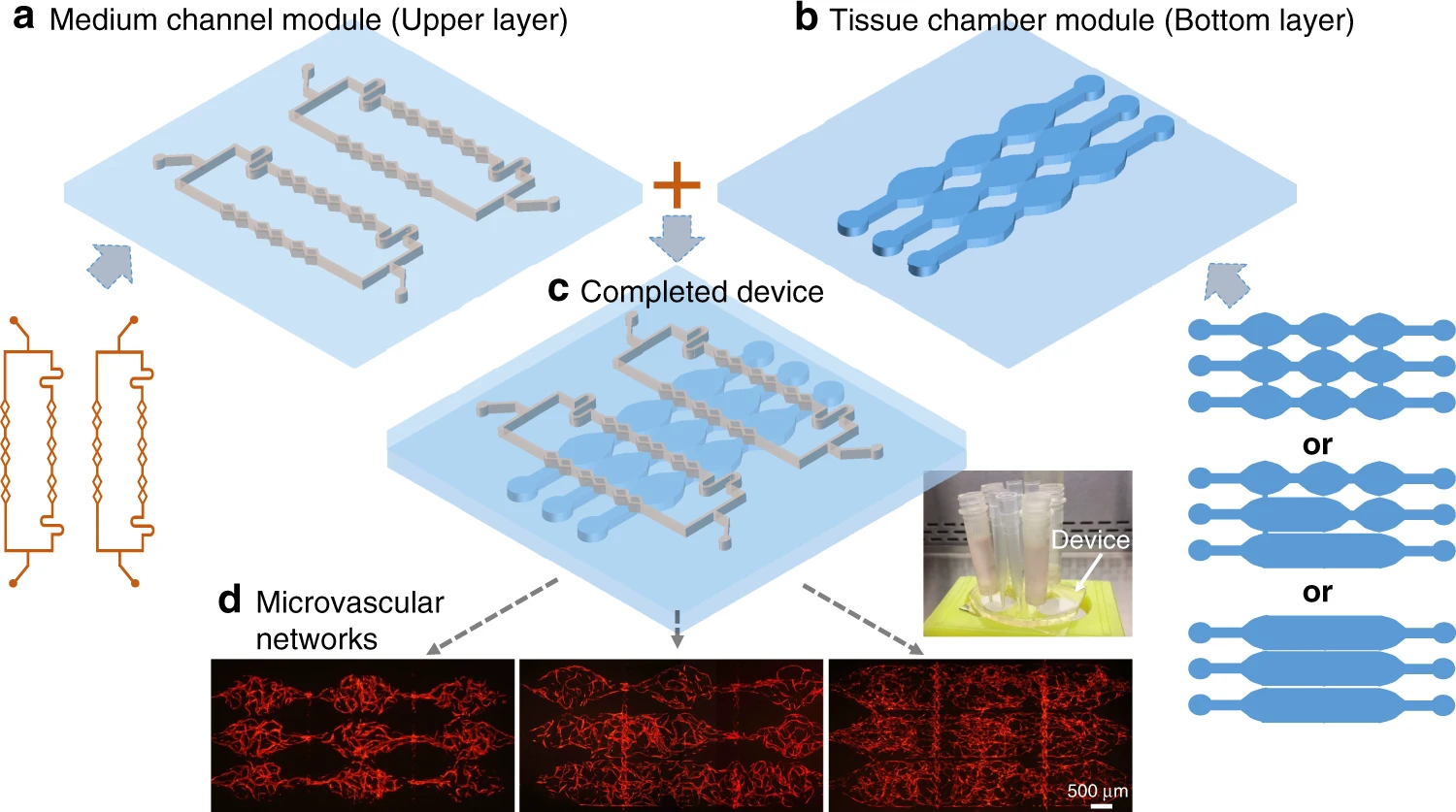
- (a)培养液通道模块(上层)和(b)组织腔模块(下层)。这两个模块可使用不同的通道设计。
- (c)一个完整的两层芯片装置展示了培养液通道和组织腔的组合。
- (d)使用不同模块配置构建的大规模可灌注微血管网络。
具有两个PDMS层的模块化微流控系统实现了具有空间三维结构的大规模、互连、多室的微血管网络。用于输送培养液的通道和组织腔室分别在两个PDMS层中构建。如图1(a,b,c)所示,将组织腔和培养液通道对齐并粘合在一起,以形成具有各种通道配置的微流控芯片。上层的培养液通道设计有4条管线,可将培养液供应到下方的组织腔中。下方的组织腔基于先前的菱形基本构型,设计了三种腔室:菱形、半矩形和矩形,以形成各种不同配置。因为不同的上层和下层可以自由组合,并且不同的通道-腔室组合可以形成各种流体流动条件,用于诱导血管形成,所以该系统构成了模块化的微血管器官芯片。
Fig. 2 Schematic drawing of an example of a device and the simulated flow conditions inside
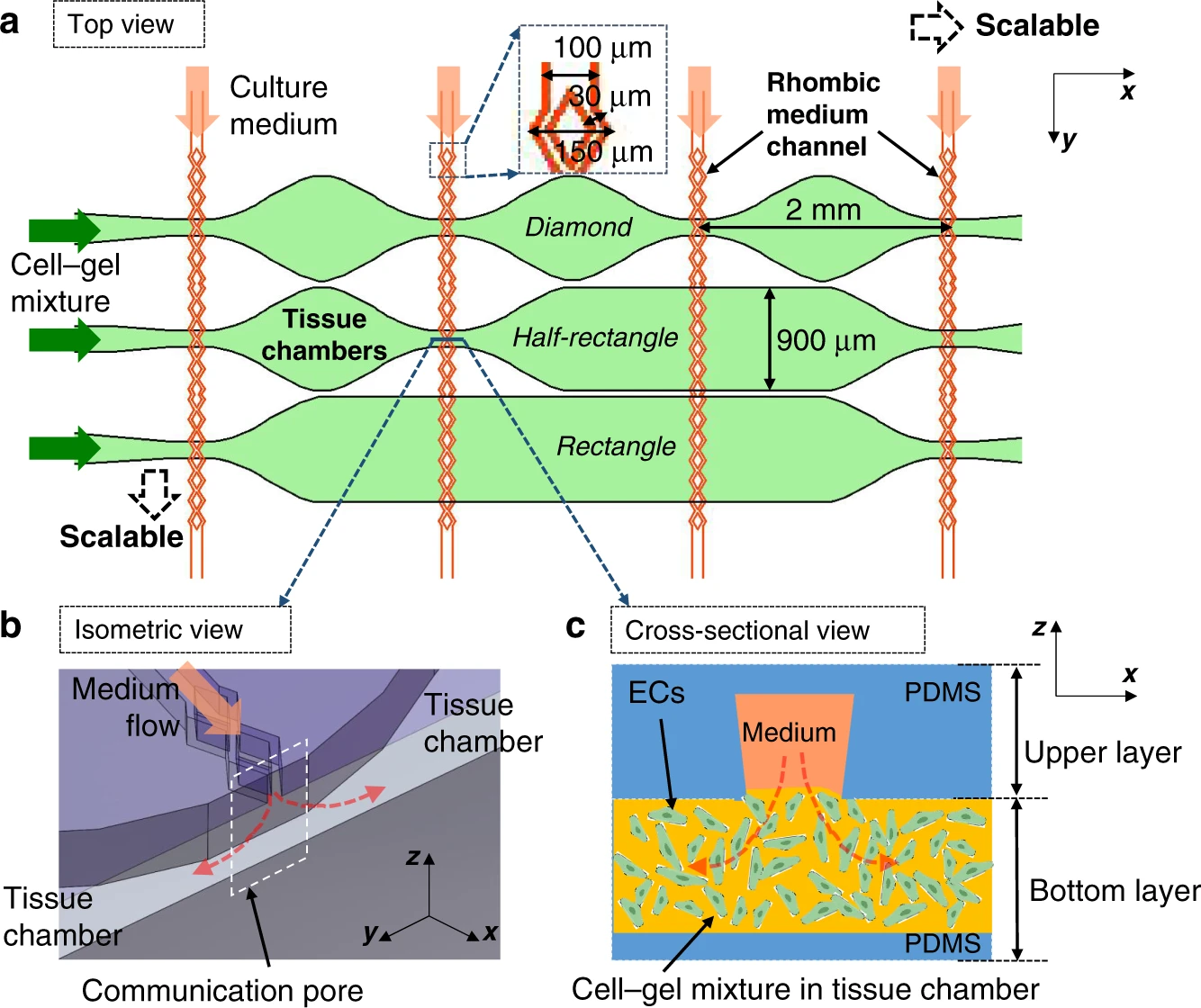
- (a)具有3××3组织矩阵的设备布局的顶视图。将细胞包埋的纤维蛋白凝胶加载到底部组织室中。然后,通过上部培养基通道供应培养基。
- (b)连通孔的等轴视图显示了介质如何从介质通道流到组织腔。
- (c)连通孔的横截面图显示了内皮细胞(ECs)如何形成连接介质通道和组织腔的腔。
由于在该系统中可以使用上层和底层的各种组合,图2中显示的一个组合作为一个例子来描述设备设计和制造的概念。上层培养基通道的直部宽度为100 μm,斜方部宽度为150 μm。菱形部分的分叉通道宽度为30 μm。在底层,组织室阵列由三种类型的组织室组成,包括菱形、半矩形和矩形形状的组织室。
对于每个设备,上层和底层都是由使用标准软光刻技术制成的。微流控通道和组织腔高度均为100 μm。如图2a所示,上层和底层在显微镜下对齐,并通过等离子体键合。粘接后覆盖上层培养基通道和底层组织腔。培养基-组织覆盖地区(以下简称“覆盖区域”)来表示连接形成一个开放空间媒介渠道和组织室,称为连通孔,如图2b、c所示。键合后,将无底塑料瓶用作培养基储罐,将其粘贴到培养基通道入口和出口的顶部。在随后的实验中使用之前,将制成的器件在121°C下高压灭菌30°min。
Fig. 3 Numerical simulations of flow inside the tissue chambers
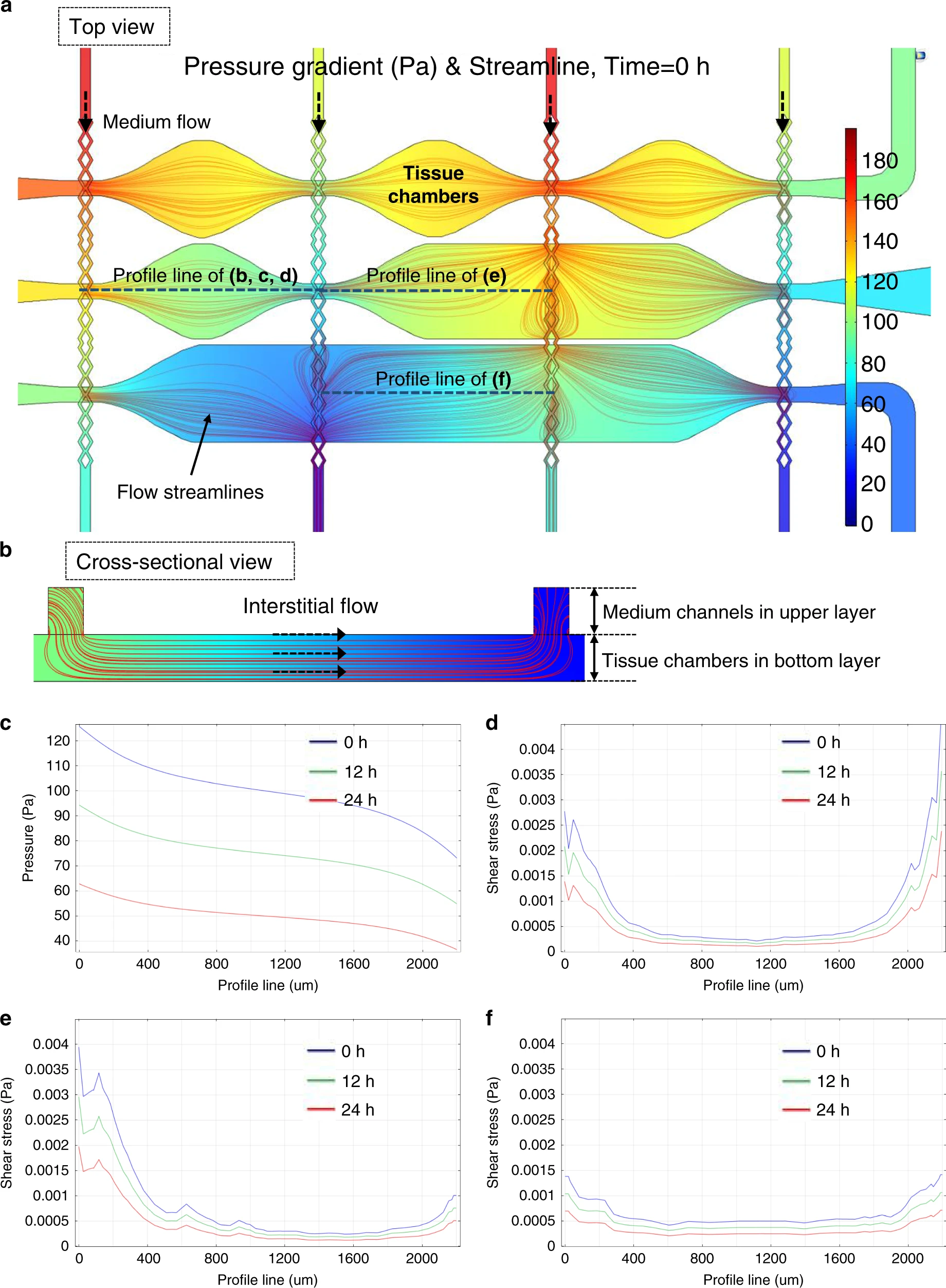
- (a)三种类型的腔室(菱形腔室,半矩形腔室和矩形腔室)的压强梯度和流线。
- (b)培养液从上层培养液通道扩散到组织腔中,在内部产生间隙流。
- (c)横跨一个组织腔的压强差约为50 Pa,足以刺激血管生长。
- (d)菱形、(e)半矩形和(f)矩形组织腔内部的剪切应力分布不同,用于研究各种流动条件以诱导形成更大、更密集的微血管网络。
在图3(a)的模拟中,液体流动是由微流控通道内的静水压力驱动的,而纤维蛋白原水凝胶则置于组织腔内。组织腔具有三种不同的设计:菱形、半矩形和矩形,用以研究不同的组织腔形状如何影响内部的间隙流情况。不同颜色表示压强梯度,红线表示流线。如图3(b)所示,由于纤维蛋白原水凝胶是一种多孔材料,因此通过它的培养液会产生间隙流。从上层培养液通道灌注培养液,在下层组织腔中产生类似组织间液的间隙流,从而为微血管的生长提供刺激。如图3(c)所示,从一个腔室的左端到右端的压降在不同时间点约为50 Pa。根据我们之前的数据,这种两层结构提供了足够的压强梯度来刺激血管生长。通过比较不同的组织腔设计,来验证剪切应力的分布是决定腔室内微血管网络的生长和连通性,特别是血管长度和密度的关键调节因素。菱形、半矩形和矩形组织腔室内的剪切应力分布分别如图3(d,e,f)所示。尽管这三种腔室设计中的最低剪切应力几乎相同,但矩形腔室的平均剪切应力最低,分布更均匀。这里,我们以一个芯片中同时具有三种不同形状的配置为例,以计算不同的间隙流动曲线。在实际实验中,则可以使用任意布局,只要保证与培养液通道对齐即可。
Fig. 4 Semiclosed rhombic medium channels were fabricated using plastic molds
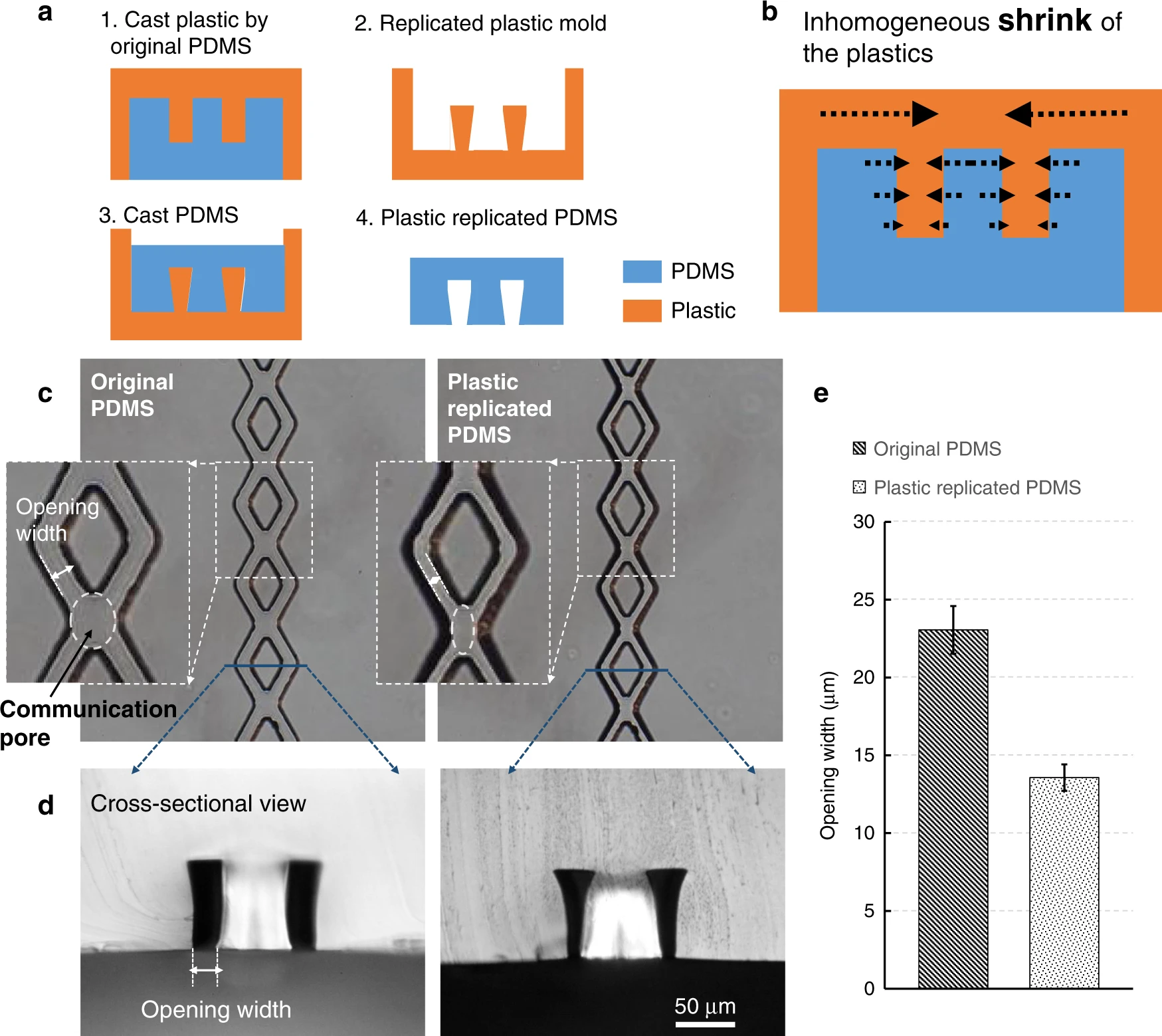
- (a)制造半封闭菱形培养液通道的塑料倒膜PDMS制备工艺。
- (b)塑料的不均匀收缩机制导致PDMS通道形成半封闭的截面结构。
- (c)原始PDMS和基于塑料倒膜复制的PDMS,显微图像显示出开口宽度和连通孔的尺寸都减小了。
- (d)剖视图清楚地显示了半封闭的培养液通道。
- (e)数据表明,开口宽度可以减小到原始通道宽度的一半左右。
使用菱形培养液通道可以有效防止培养液注入时产生气泡堵塞通道。菱形培养液通道的交叉部分是血管网和培养液通道的连通孔。由于这些孔比分开的菱形通道相对更宽,当水凝胶注入组织腔时,这些孔处有可能发生水凝胶泄漏,堵塞培养液通道。为了避免该问题,必须减小这些孔的尺寸。然而,在减小连通孔的尺寸之后,菱形通道太窄以至于不能通过足够的培养液用于细胞生长。因此,理想的解决方案是只减小底部开口的宽度以使其半封闭,同时保持菱形通道顶部的宽度,减少流量损失。但是,通过常规的标准软光刻技术很难实现沿垂直方向的这种非均匀形貌制造。在这种情况下,我们基于塑料倒膜的新颖制造方法,生成了一种半封闭的菱形培养液通道。图4(a)显示了工艺流程。在固化期间,塑料的线性尺寸将以4%的比例收缩,因此这些塑料模具的特征尺寸与原始SU-8模具的特征尺寸略有不同。从理论上讲,塑料的收缩率是各向同性的。但是在成型过程中,由于微流控通道的几何形状不均一,导致不同平面上实际收缩的距离不同,因此浇铸出来的塑料模具会产生如图4(b)所示的效果。从这些塑料模具复制的最终PDMS通道中的开口宽度小于从原始SU-8模具铸造得到的开口宽度。该方法操作简单,可以用于非均一截面的微流道加工。
Fig. 5 ECs grew vertically at communication pores to form a leakage-free seal between the microvascular networks and medium channels
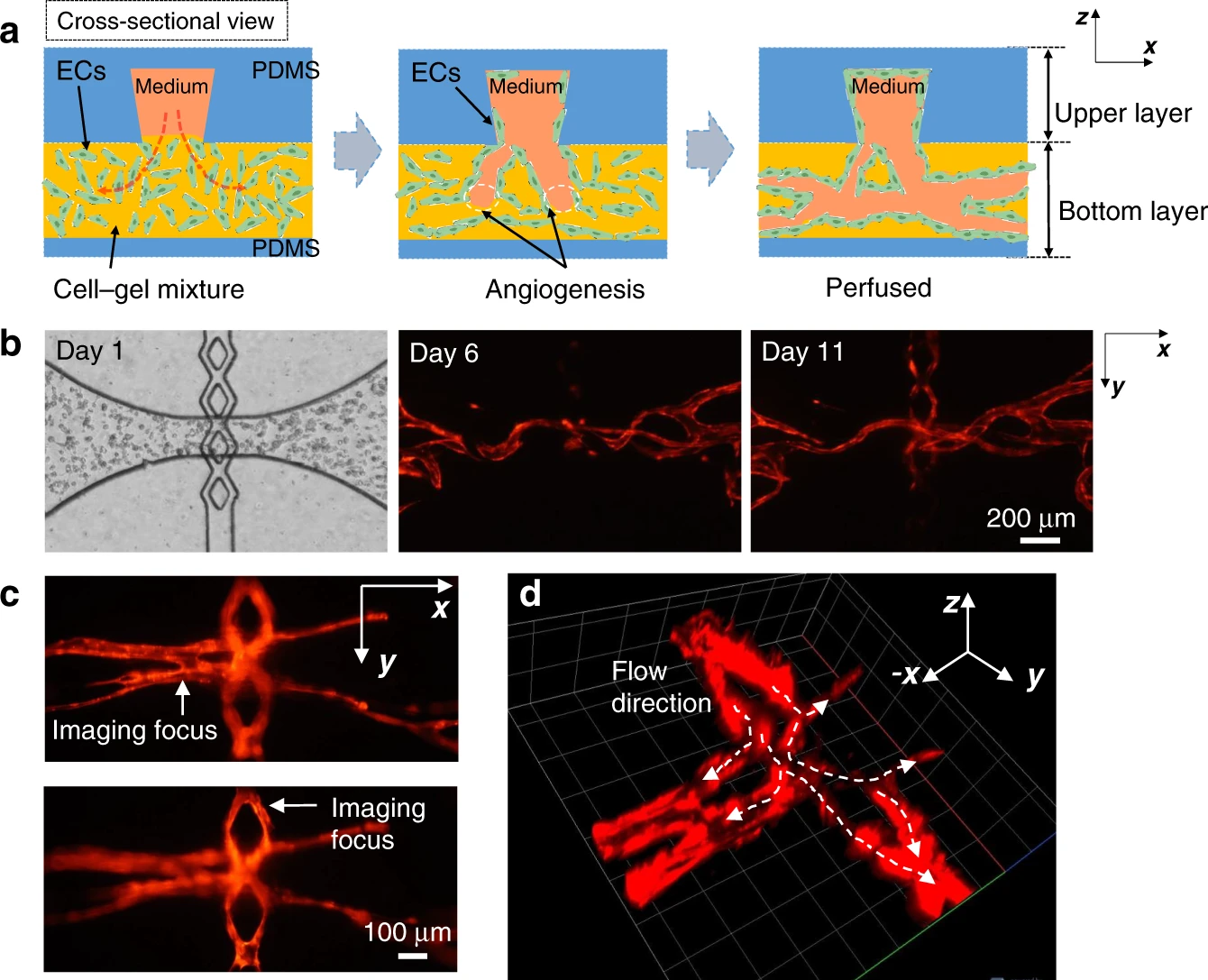
- (a)内皮细胞在连通孔处进行垂直吻合的示意图,细胞密封了内壁并形成了连接。
- (b)延时图像清楚地表明,内皮细胞在连通孔处生长并形成连接。
- (c)展示了上下层之间连接的不同图像。
- (d)共聚焦图像显示了连通孔处培养液如何流入下层的毛细血管。
如图5(a)所示,下层组织腔连通孔附近的内皮细胞垂直向上生长到上层的培养液通道中,密封流道内壁并在培养液通道与组织腔室之间形成紧密连接。这是由于培养液从上层通道流入下层组织腔,产生刺激内皮细胞迁移的流体剪切力梯度。这种垂直迁移最终将微血管网络和培养液通道连接起来,在连通孔处形成无泄漏的密封,我们称之为“垂直吻合”。图5(b)中的延时图像清楚地显示了内皮细胞向连通孔迁移,从而形成垂直吻合。图5(c)通过不同的成像焦平面展示了位于培养液通道和组织腔室中内皮细胞。图5(d)的共聚焦图像展示了组织腔微血管网络与上层培养液通道的完全连接。
Fig. 6 Various microvascular networks are generated in the modular microfluidic system
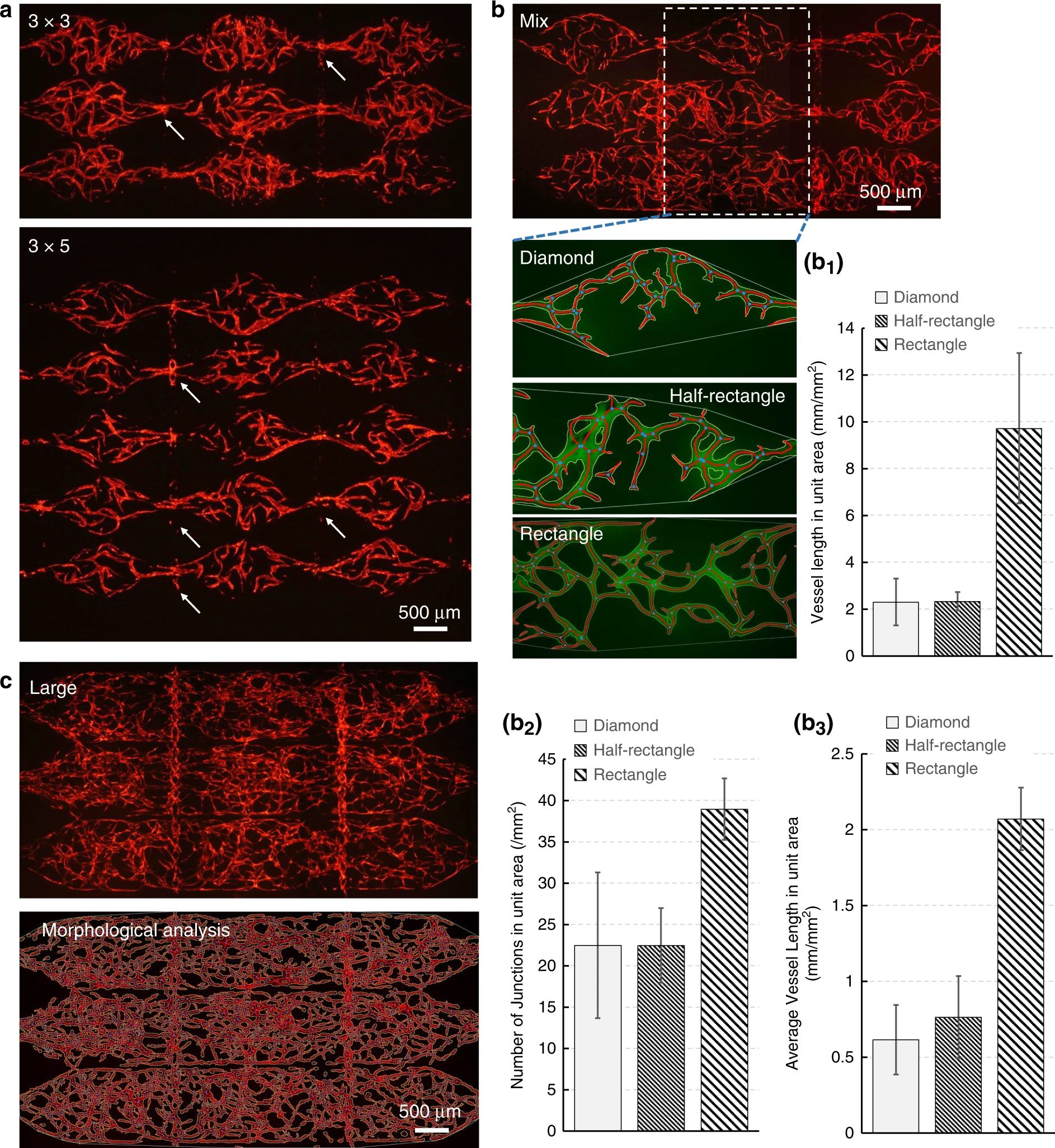
- (a)通过将组织腔矩阵从3x3扩展到3x5证明了模块化系统的可扩展性。
- (b)分析了菱形、半矩形和矩形腔室构建的毛细管网络的不同形态学特性,矩形组织腔构建的毛细血管网络规模最大。
- (c)由包含三排矩形腔室的组织腔构建了覆盖面积超过14 mm2,密度为12 mm/mm2的大规模微血管网络。
作为模块化微流控系统,我们测试了3×3和3×5两种不同组织腔的矩阵布局,以验证其可扩展性。如图6(a)所示,两种布局都成功生成了微血管网络,并且观察到垂直吻合。该模块化系统的另一个优点是灵活性,可在组织腔中提供各种不同的流体环境,这些流体环境可用于研究生成更大、更密集微血管网络所需的流体环境条件。如图6(b)所示,使用面积分别为1.1 mm2,1.7 mm2和2.1 mm2的菱形、半矩形和矩形腔室构建不同的血管网络,并通过单位面积的血管总长度、结点数量和血管平均长度进行形态特性分析。结果显示,矩形腔血管网络的三个参数均具有最高值,因此这个构型为生成大规模微血管网络的最佳配置。同时该结果也印证了图3所示的三种类型腔室的流体数值模拟结果,表明较低水平的剪切应力促使更长和更密的血管网形成。图6(c)显示了三排矩形组织腔室中构建的大规模微血管网络,定量分析结果表明,微血管网络的覆盖面积超过14 mm2,密度为12 mm/mm2。
Fig. 7 70-kDa FITC-dextran perfusion demonstrated the tight interconnections between the microvascular networks and the medium channels
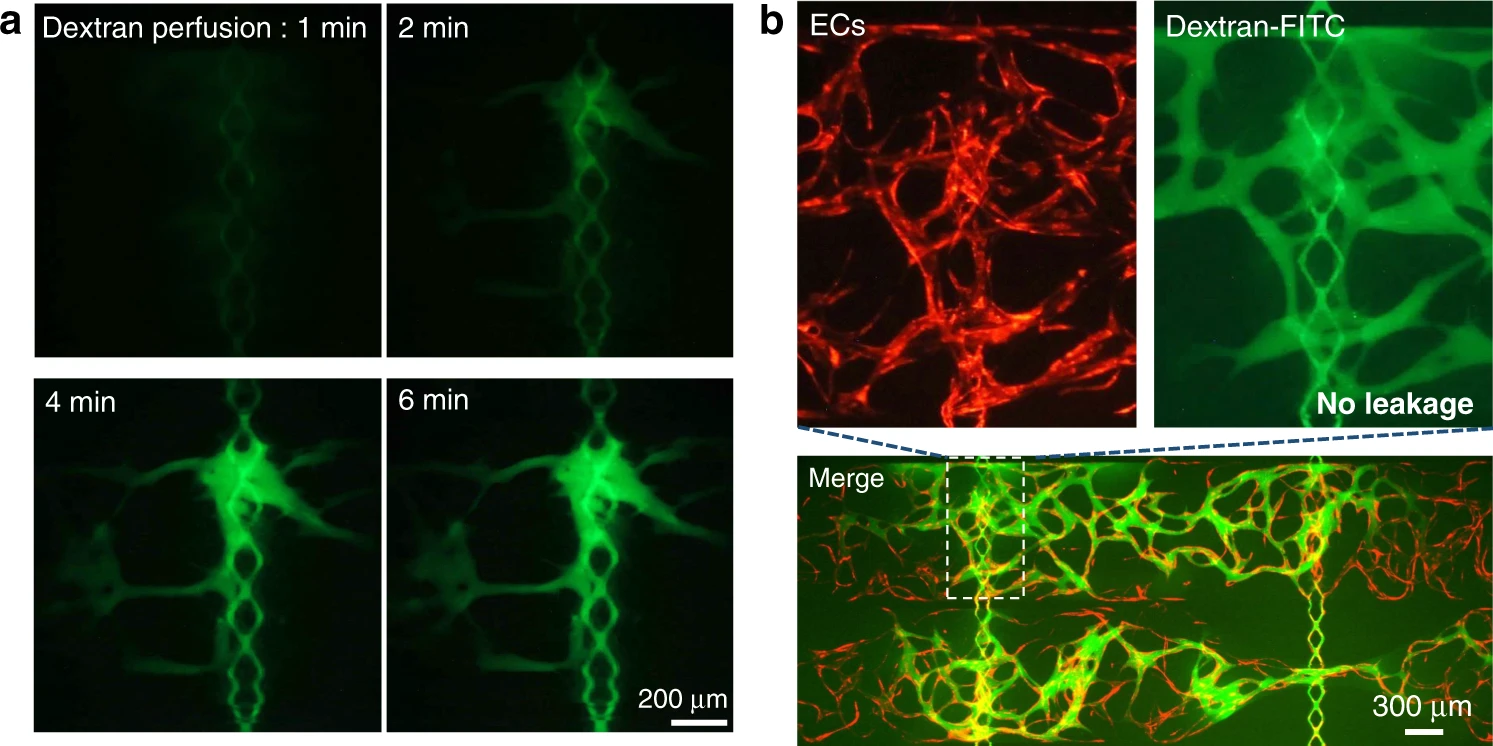
- (a)FITC-葡聚糖从中等通道向毛细血管灌注的延时图像显示了连通性和灌注性。
- (b)整个灌注的微血管网络显示出微血管网络的强大屏障性能和吻合的紧密性。
为了验证微血管网络的完整性和连通孔处垂直吻合的发生,在整个装置中灌注了70 kDa FITC-葡聚糖。选择葡聚糖(70 kDa)是因为它的分子量接近人血浆白蛋白(分子量约66.5 kDa),是人血浆中的主要蛋白质,适合用于测试内皮屏障功能。图7a示出了从培养基通道到微血管网络的FITC-葡聚糖灌注的延时图像。将FITC-葡聚糖上样至培养基入口后,使用荧光显微镜连续监测连通孔处的染料流动。当介质通道中出现绿色荧光时,开始延时记录。在2分钟内,FITC-葡聚糖开始通过连通孔灌注到微血管网络中。随着时间的流逝,由于葡聚糖流入增加,血管腔中的荧光强度增加。 6分钟后,FITC-葡聚糖已通过连通孔附近的血管,并充满了下方组织室内的整个微血管网络。这证明了微血管网络的连通性和灌注性。此外,在整个灌注测试期间,在血管外部,包括在ECs形成垂直吻合的连通孔中,均未在血管外观察到FITC-葡聚糖。如图7b所示,大约15至20分钟后,FITC-葡聚糖充满了整个微血管网络,并且FITC-葡聚糖没有明显的非生理性渗漏,尤其是在整个连通孔区域内。
对于不同的腔室布局(菱形,半矩形和矩形),上部介质通道覆盖的区域是不同的,并且需要不同数量的ECs才能形成用于无泄漏吻合的合格涂层。另一方面,较大的覆盖面积导致大量的连通孔,ECs可以通过这些连通孔迁移到培养基通道中并使该区域内皮化。如图6a-c所示,在相同的培养时间(11天)后,矩形腔室中的内皮化通道(菱形中等通道显示红色花序)比菱形腔室中的内皮化通道更多意味着具有不同腔室布局的设备已被内皮化,并准备在相似的时间范围内使用。总之,证实了由微血管网络和介质通道之间的紧密互连所导致的连通孔处的无泄漏密封。另外,已经证明了微血管网络的强大内皮屏障和吻合的紧密性。
Discussion
- 在以前的设计中,由于没有次级通道连接到ECM,在微血管网络形成后很难将细胞或化合物引入细胞外基质(ECM)。但是通过这种两层配置,向底层添加更多通道以提供其他途径,使随后引入细胞或收集血管间流出物进行定量分析变得可行。
- 连接多排组织腔,这些组织腔被分成单层配置。使用此处描述的垂直吻合结构,使每个组织行之间的直接通信变得可行。如果将不同的细胞类型装载到不同的行中,则可以通过腔室之间的微血管网络或腔室上方的微流体通道(代表动脉或小静脉血管)实现不同组织腔室之间的连通。
- 本文使用的矩形组织腔产生了最密集的微血管网络。这样的结果表明组织腔室几何形状与在腔室内部形成的微脉管的密度之间的相关性。换句话说,腔室内的流体状况调节了微血管的发育。据报道,流体剪切应力衰减ECs发芽,间隙流动的较低的剪切应力促进内皮形态发生和幼芽形成。因此,在矩形组织腔中,剪切应力低于具有其他形状的腔室中的剪切应力,这表明较低的剪切应力导致更多的血管发芽和更密集的血管网络。
Conclusion
开发了一种模块化的微流控系统,用于使用两层PDMS配置大规模形成灌注的血管化组织。也开发了一种新颖的基于塑料模具的制造方法来生成半封闭的菱形介质通道。
使用这种两层模块化微流系统可生成具有复杂形态和密度的微血管网络。证实了在底层的毛细血管和上层的培养基通道之间的垂直吻合,并且证实了70 kDa FITC-葡聚糖灌注而没有非生理性渗漏。
Reference
Yue T, Zhao D, Phan D T T, et al. A modular microfluidic system based on a multilayered configuration to generate large-scale perfusable microvascular networks[J]. Microsystems & Nanoengineering, 2021, 7(1): 1–13.



