
一种基于气动的微流控芯片,用于三维肿瘤形成与收集。
Introduction
三维肿瘤如多细胞肿瘤球已经引发了癌症研究者的大量兴趣并应用于广泛的抗肿瘤药物评估研究。归因于它们在模拟体内肿瘤微环境上通过复制营养和信号梯度及移除在人工表面和凝胶上的非自然吸附所增加的精度。
然而,关于三维肿瘤形成和维持仍存有挑战,微尺度的细胞和流体操纵以及溶液交换目前阻碍了经过充分验证的肿瘤组织模型的广泛使用。过去的三维肿瘤培养方法存在单调冗长、劳动密集以及在大量生产上受限的缺点。因此需要新的简单的、受欢迎的方法以大量产生均匀的三维肿瘤。
微流控芯片以其对微流控灌注和肿瘤细胞的时空控制上出众表现被认为是一个有前景的平台。然而,用于芯片上控制、培养/形成、通量后分析和恢复仿生三维肿瘤以扩大微流控技术在肿瘤表征中的应用范围的微操作线尚未完全实现。
作者提出了用于一系列三维肿瘤顺序控制包括细胞定位、三维肿瘤形成、在线分析和通过含设计好的气动微结构(PμSs)的微流控芯片进行动态微操作来回收三维肿瘤的一个简单、通用且可复制的方法,并且完成了一次实时通过纳米医疗靶向肿瘤的原型验证应用。
Fig. 1 Microfluidic device with second-generation pneumatic microstructure (PμS) arrays for the controllable production of 3D tumors
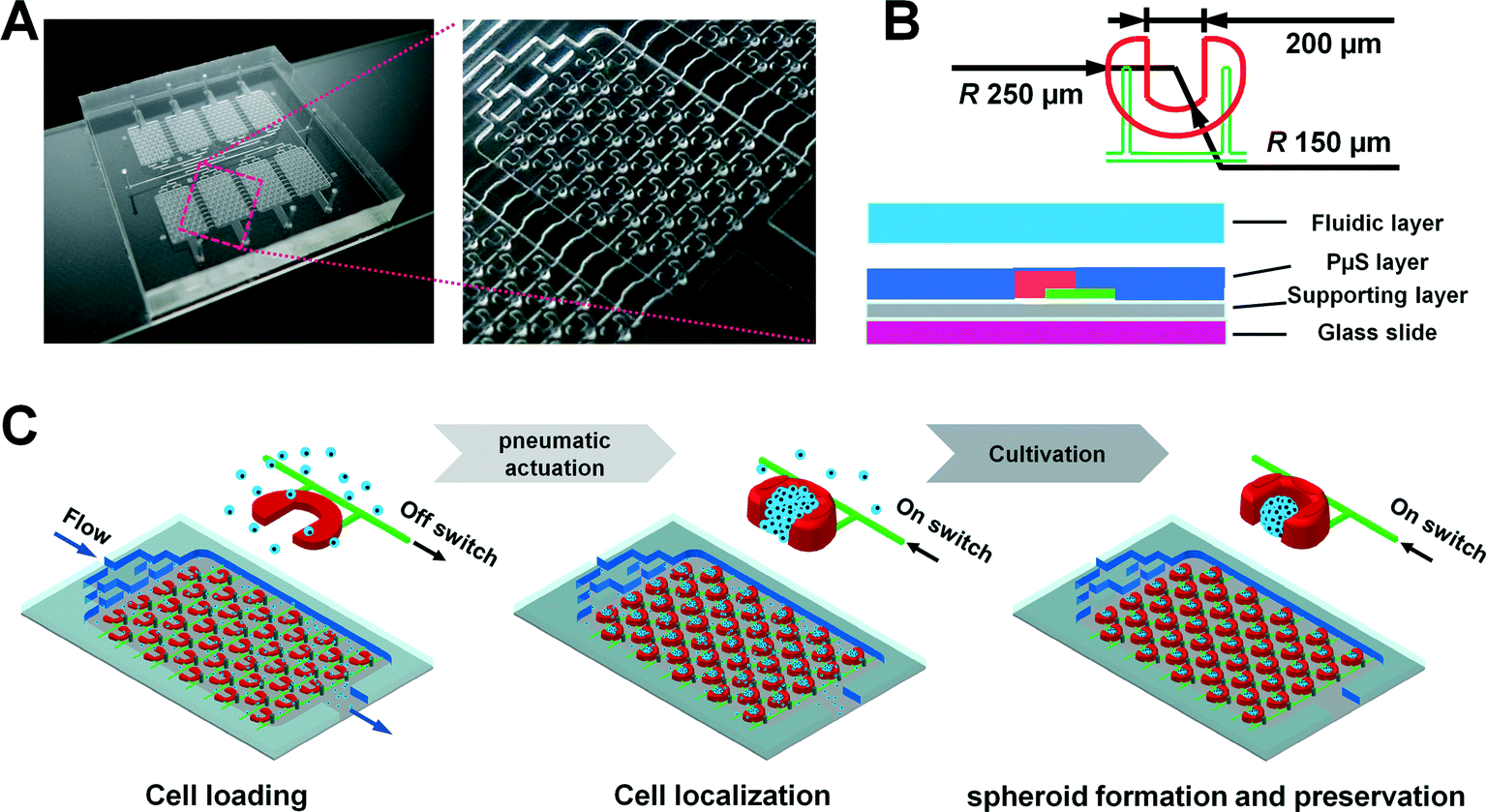
- (A)左图为微流控装置。右图显示了微腔中相对应的PμS,每个腔室有45个PμSs。
- (B)PμS的设计(上图)和装置的截面图(下图)。
- (C)PμS阵列操作用于精确细胞定位与微腔中高通量的三维肿瘤形成与维持的示意图。
Fig. 2 PμS-assisted localization of tumor cells in the microchamber in a high throughput manner
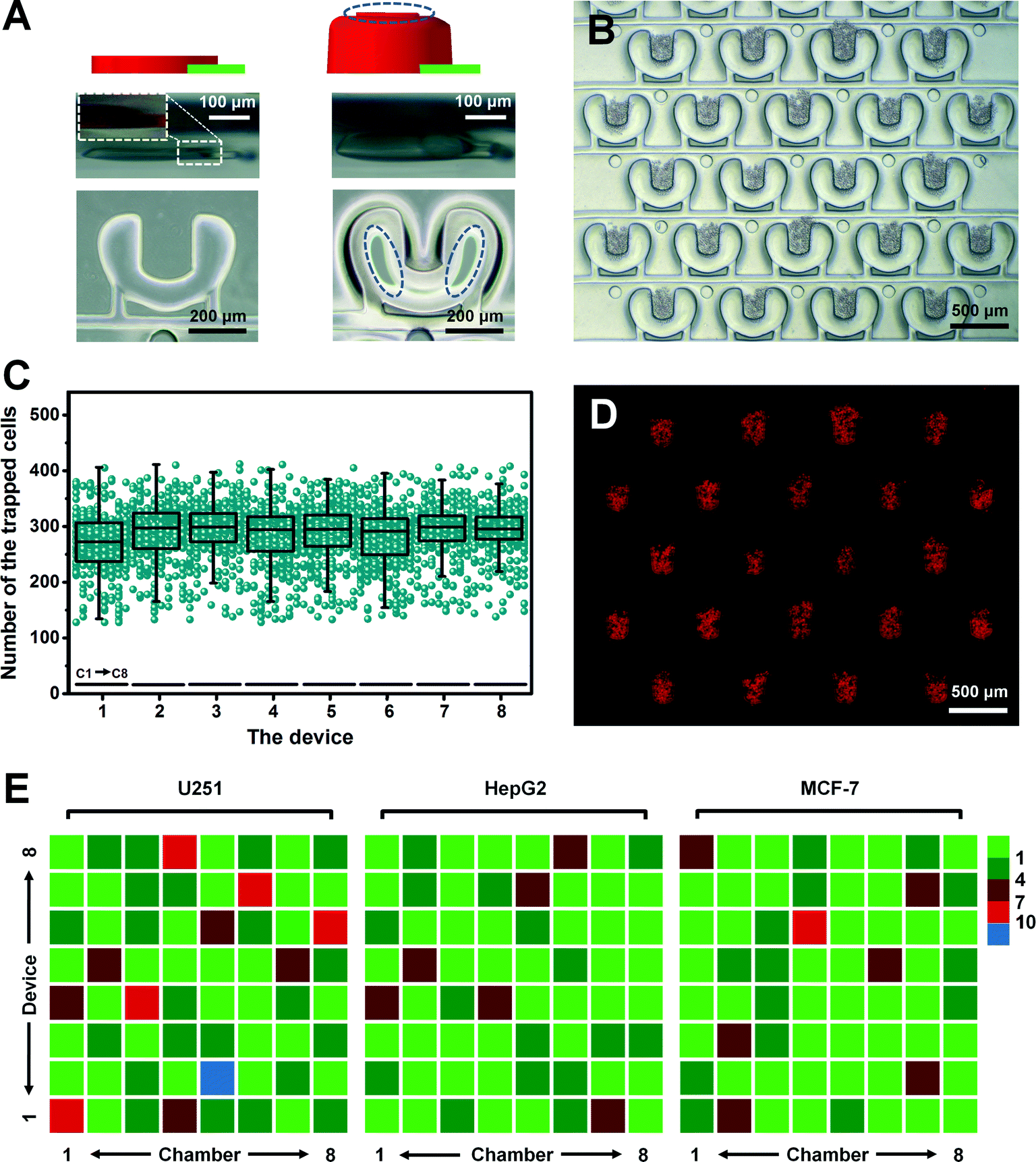
- (A)图像展示了PμS开(左)、关(右)切换。侧视图和俯视图分别位于上中部和下部。放大的图像(左中)是一个PμS的侧方展示,连接通道装载了红色染料,清楚地展示了两个部分的高度差。椭圆虚线区(右上和右下)表明PμS接触到微腔顶部。驱动PμS的压力为20 psi。
- (B)微腔中PμS阵列捕获的U251细胞光学显微图。
- (C)捕获的U251细胞数。C1-C8代表不同的微腔。
- (D)对应于(B)的被捕获U251细胞荧光染色图。细胞被DiI(红)预标记以追踪细胞。
- (E)Pluronic F127预修饰的PμS微腔精确细胞定位的评估。数据显示剩余在腔室中非特异性捕获区域的多余细胞数。
Fig. 3 Array-like 3D tumor formation
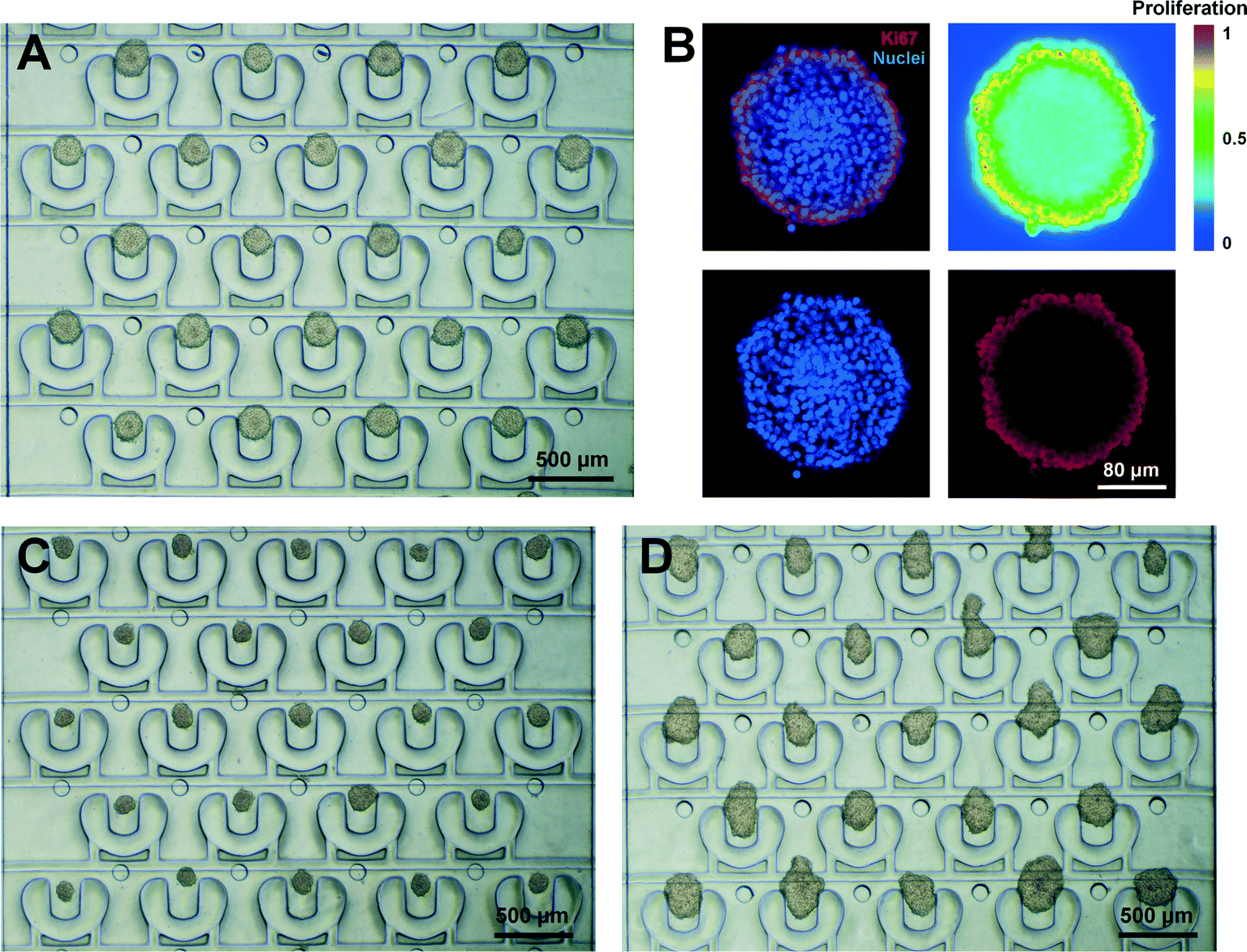
- (A)培养10天后,阵列样的U251肿瘤维持在驱动的PμS阵列中的光学图像。
- (B)培养U251肿瘤10天后,Ki67(红色)和核(蓝色)荧光染色图像。右上图显示相关于细胞增殖的Ki67蛋白质的荧光强度分布。
- (C)培养10天后,MCF-7肿瘤阵列的光学图像。
- (D)培养5天后,HepG2肿瘤阵列的光学图像。
Fig. 4 Real-time assessment of both the size and shape of U251, HepG2 and MCF-7 tumors
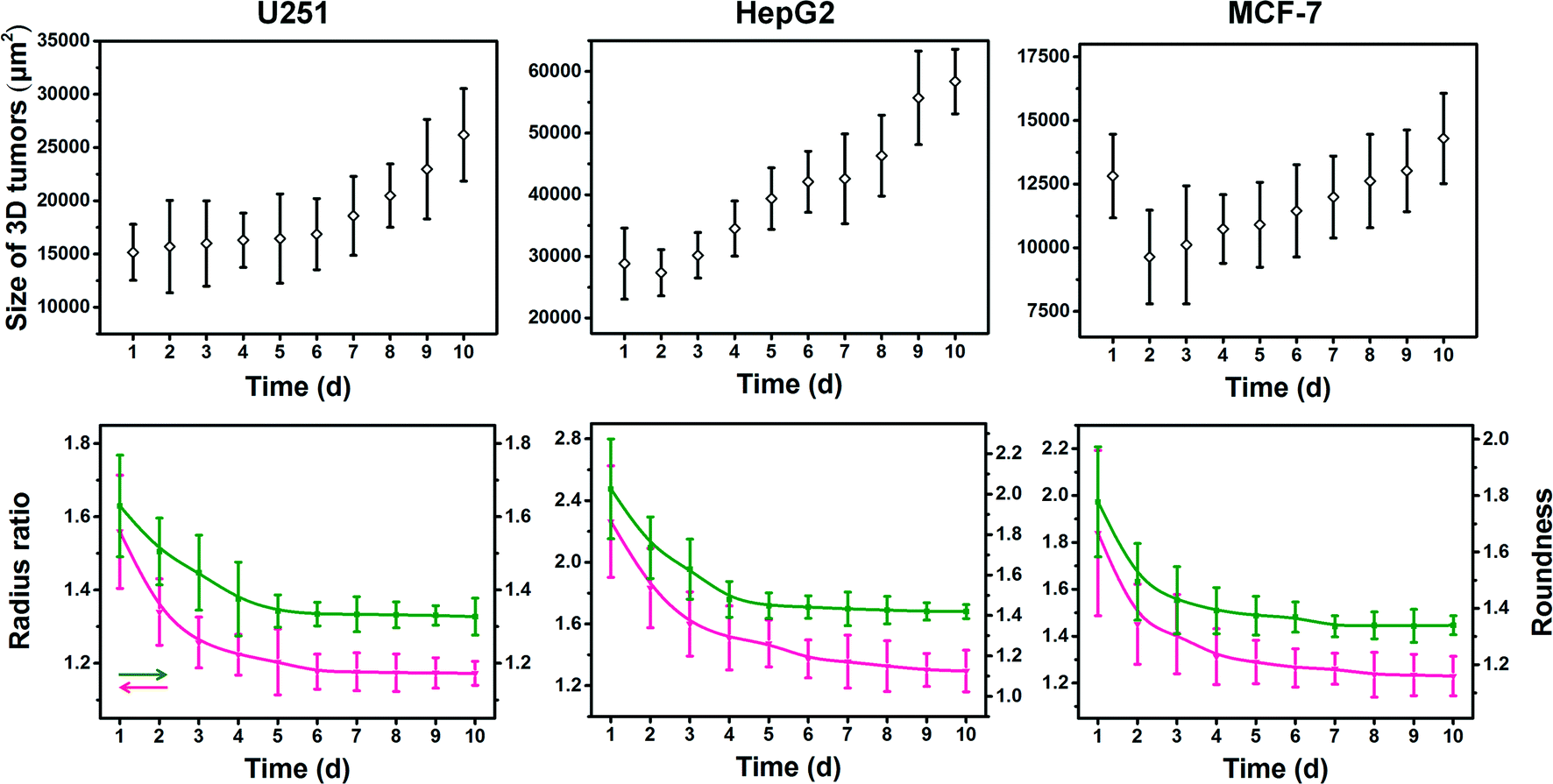
U251、HepG2和MCF-7肿瘤的尺寸和形状的实时评估。三维肿瘤的面积、半径比和圆度被用来确定结构动力学。
Fig. 5 Real-time recovery of 3D tumors
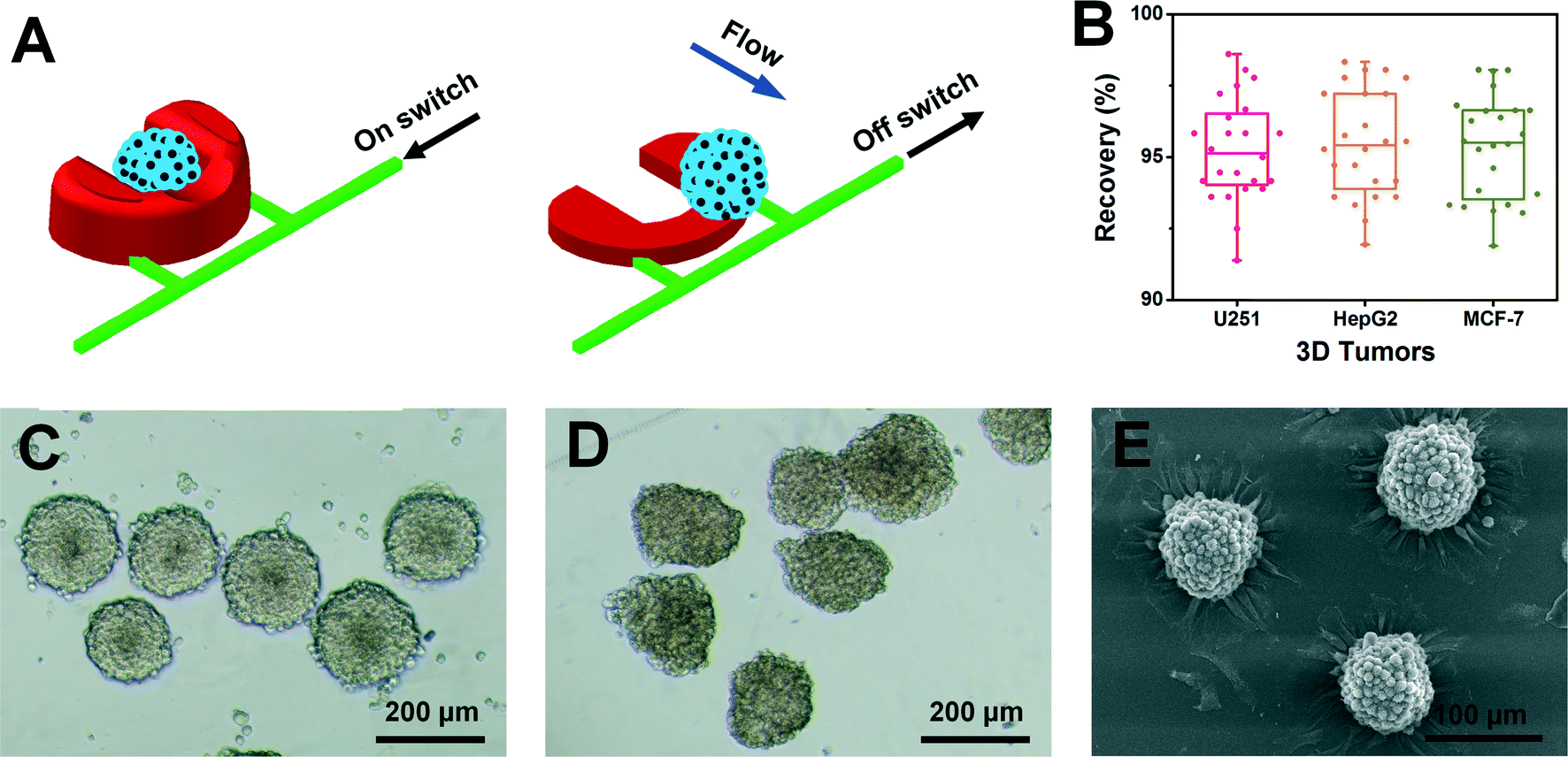
- (A)通过简单的关闭PμS开关,三维肿瘤回收的示意图。
- (B)定量三维肿瘤的回收率。
- (C)培养10天后回收的U251肿瘤的光学图像。
- (D)培养7天后回收的HepG2肿瘤的光学图像。
- (E)培养10天后回收的MCF-7肿瘤的SEM图像。
Fig. 6 Targeted nanotherapy of U251 tumors
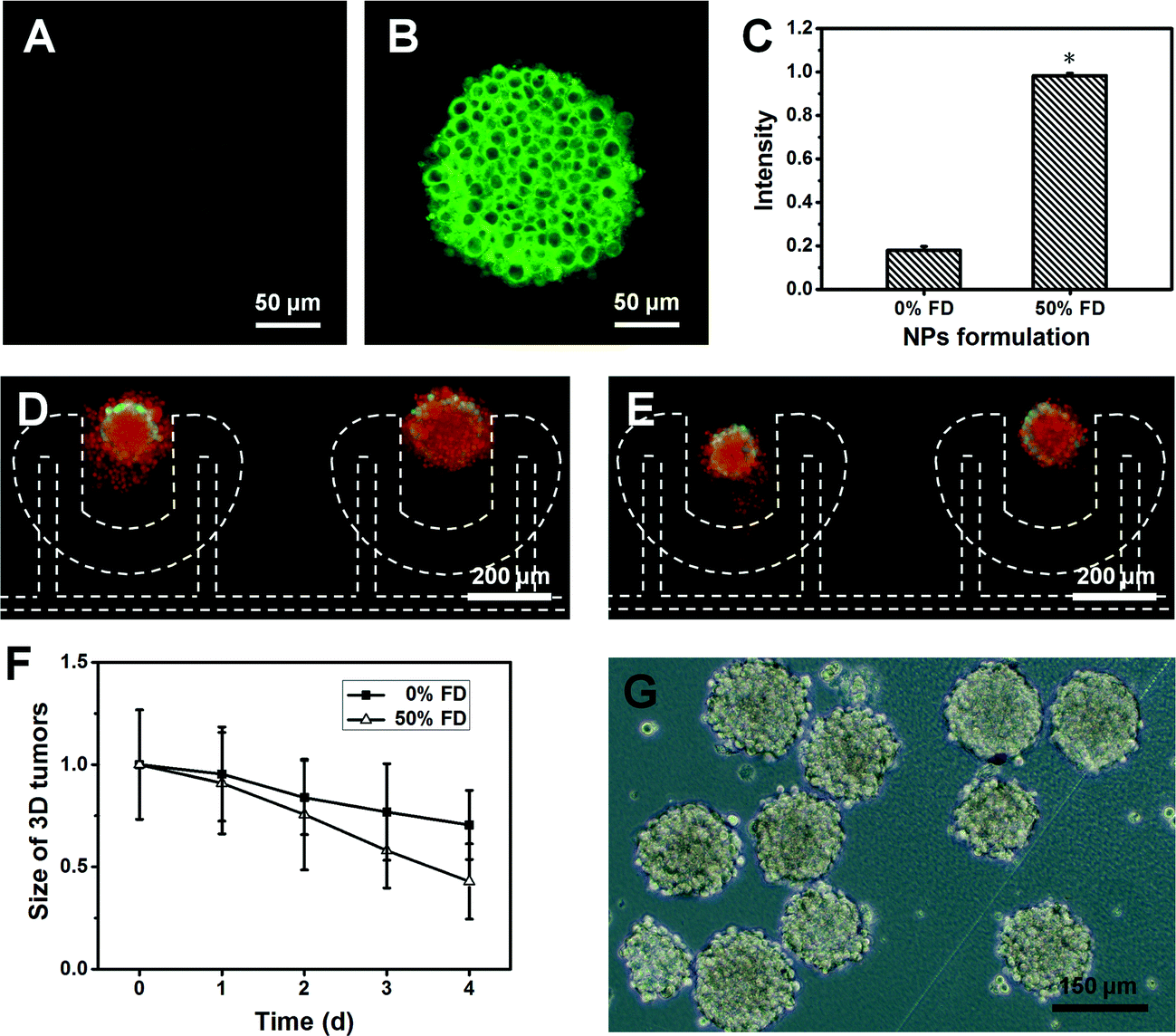
- (A)荧光图显示孵化2小时后,香豆素6装载的0%FD-NP(叶酸修饰的杂化聚合物纳米粒子)在10天的U251肿瘤中的穿透。注:应该有一点绿的,详见PDF,这图看不出来。
- (B)荧光图显示孵化2小时后,香豆素6装载的50%FD-NPs在10天的U251肿瘤中的穿透。
- (C)定量分析细胞摄取香豆素6装载的0%FD-NPs和50%FD-NPs在三维肿瘤中的量。
- (D)紫杉醇装载的0%FD-NPs处理4天的U251肿瘤的FDA/PI染色荧光图。
- (E)紫杉醇装载的50%FD-NPs处理4天的U251肿瘤的FDA/PI染色荧光图。
- (F)使用紫杉醇装载的0%FD-NPs和50%FD-NPs处理的三维肿瘤正则化的大小动力学。
- (G)使用紫杉醇装载的50%FD-NPs处理1天后回收的U251肿瘤的光学图像,提示这种回收能力可以用于接下来的流式细胞术。
Fig. 7 Flow cytometry analysis of apoptosis by double staining with Annexin V-FITC and PI
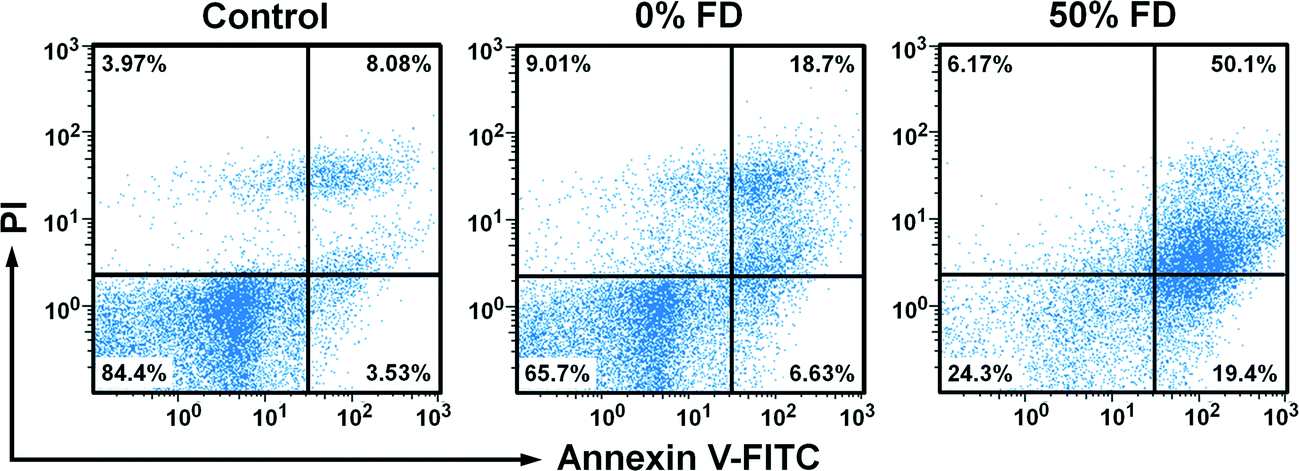
流式细胞术测试经过紫杉醇装载的0%FD-NPs和50%FD-NPs处理4天后的U251细胞。同0%FD-NPs相比,50%FD-NPs导致了更高比例的annexin-V+(膜联蛋白-V)/PI+细胞;同时,annexin-V+/PI-细胞比例增加意味着更高比例的三维肿瘤细胞开始凋亡。
有关此处凋亡检测,科普。
Conclusion
提出了一种气动微结构的微流控芯片,以高通量的形式产生三维肿瘤。
- 建立了一种芯片上的操作线包括一步的细胞定位、阵列样形成和实时分析多种肿瘤。
- 通过动态开关气动微结构可以容易的回收肿瘤产物。
- 证明了其在评估靶向纳米治疗的应用。
Reference
Liu W, Wang J-C, Wang J. Controllable organization and high throughput production of recoverable 3D tumors using pneumatic microfluidics[J]. Lab on a Chip, 2015, 15(4): 1195–1204.



