
一种导管肿瘤微环境芯片,用于分析和实验上皮-间质转换以及伴随瘤内异质性的局部侵入。
Introduction
胰腺导管腺癌(PDAC)被认为起源于腺泡-导管上皮化生,随着关键基因突变的长期积累,通过胰腺上皮内瘤变损伤发展为侵袭性癌。这些驱动突变包括KRAS致癌基因的激活和肿瘤抑制基因CDKN2A(编码p16)、TP53(编码p53)和SMAD4的失活。强烈的增生基质与疾病的进展有关。基质主要由癌相关的成纤维细胞(CAF)和致密的细胞外基质(ECM)组成,包括I型胶原和透明质酸(HA)。这种基质最多占肿瘤体积的90%,并形成复杂的肿瘤微环境(TME)。对目前已建立的胰腺癌细胞(PCC)细胞系的基因型和表型分析表明,尽管p53被认为与转移有关,但关键基因与分化程度或生物学行为均不存在明确的相关性。最近一项PDAC的基因组分析确定了其可能相关于治疗反应的分子亚型——两种上皮型和两种基质型。为了改善患者对现有治疗方案的选择,并发展新的治疗策略,需要进一步研究PDAC的基因型特异性行为。
在这个背景下,当前肿瘤模型不足以系统地研究和比较不同基因型的PDAC和它们的TME。尽管PDAC细胞系是有价值的工具,然而:
- 标准的2D培养环境不足以充分模拟PDAC TME复杂的性质。
- 标准的体外3D模型,如球体是一个改进,但这些模型仍然不能再现PDAC的微观结构,即癌上皮细胞导管与周围间质相互作用。
- 小动物模型,包括小鼠异种移植和同种异体移植(异位和原位)模型,提供了代表细胞-细胞和细胞-基质的交流。然而肿瘤的遗传学和微解剖通常不具备人PDAC的代表性。
基因工程小鼠模型(GEMMs)可以重现人PDAC的大多数组织学和遗传学特征,包括关键驱动突变、上皮导管结构和周围的基质组织。因此,与异种移植或原位模型相比,GEMMs可能更好地预测药物疗效。然而GEMMs是昂贵的,通常需要4—8个月产生肿瘤,限制了它们用于评估与PDAC发展相关的高度可变复杂性方面的有效性。因此,人们迫切需要能够在维持体内PDAC TME环境的同时精确控制相关TME条件的新型肿瘤模型,以了解复杂的肿瘤-基质相互作用。
本研究提出了一种仿生PDAC肿瘤模型dT-MOC,是一种微流控平台,导管状PCC上皮被胶原基质包围,这正是PDAC的解剖学标志。
管腔形成使用了粘性指进。
Figure 1. Design of the ductal T-MOC platform
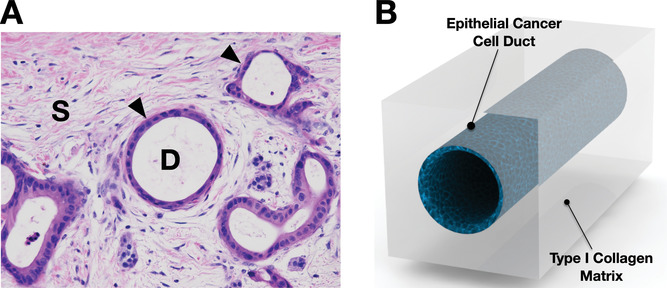
- (A)小鼠PDAC显微图显示PCC导管(以箭头和“D”标记)和间质组织(以“S”标记)的横截面H&E染色。
- (B)dT-MOC模型被设计于模拟PDAC肿瘤的微解剖结构,PCC导管被基质胶环绕。
Figure 2. Fabricated ductal T-MOC platform
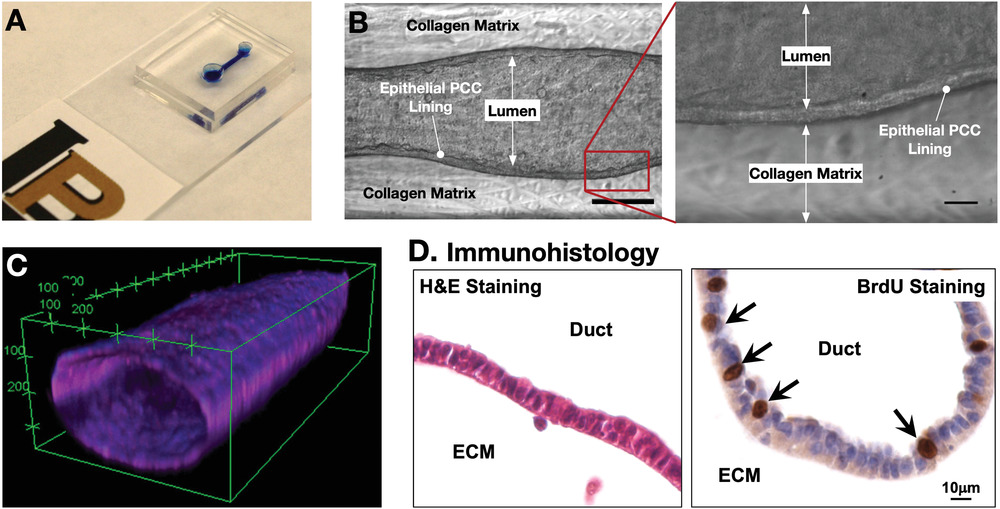
- (A)制造的一个dT-MOC的照片。装置由含有一个入口和一个出口的双层PDMS组成,由一个微通道连接。
- (B)第4天的白光图显示了腔结构的形成,有明显的上皮内衬。放大图像显示PCCs有明显的上皮内衬。
- (C)一个典型dT-MOC上的癌细胞管的共聚焦显微图片。
- (D)免疫组化图像显示了H&E和BrdU染色。
BrdU染色检测处于S期的细胞,即处于DNA复制期的细胞。BrdU是尿嘧啶核苷的衍生物,当加入到培养的细胞中时,将取代胸腺嘧啶核苷整合入S期细胞的DNA中。染色过程中,DNA必须使用DNase I降解,这对染色成功与否是非常关键的。然后用抗BrdU抗体进行染色,以鉴定BrdU整合入增殖的S期细胞。
Figure 3. Molecular analysis of cells used in dT-MOC platform

- (A)RT-qPCR结果。E-cadherin(Cdh1,上皮标记物)与Snail、MMP9和纤连蛋白(FN1)(EMT和间充质标记物)的转录水平显示这些基因在所研究的癌细胞系中异质表达。
- (B)免疫印迹分析。在mKIC细胞中证实了纤连蛋白(FN1)水平。WT胰腺、腺泡细胞系(266-6)、eKIC和KPC2样本的纤连蛋白水平可忽略不计,而mKIC显示高水平的纤连蛋白。纯纤连蛋白(Fib)作为阳性对照。
Figure 4. Local invasion of cancer cells in the dT-MOC platforms
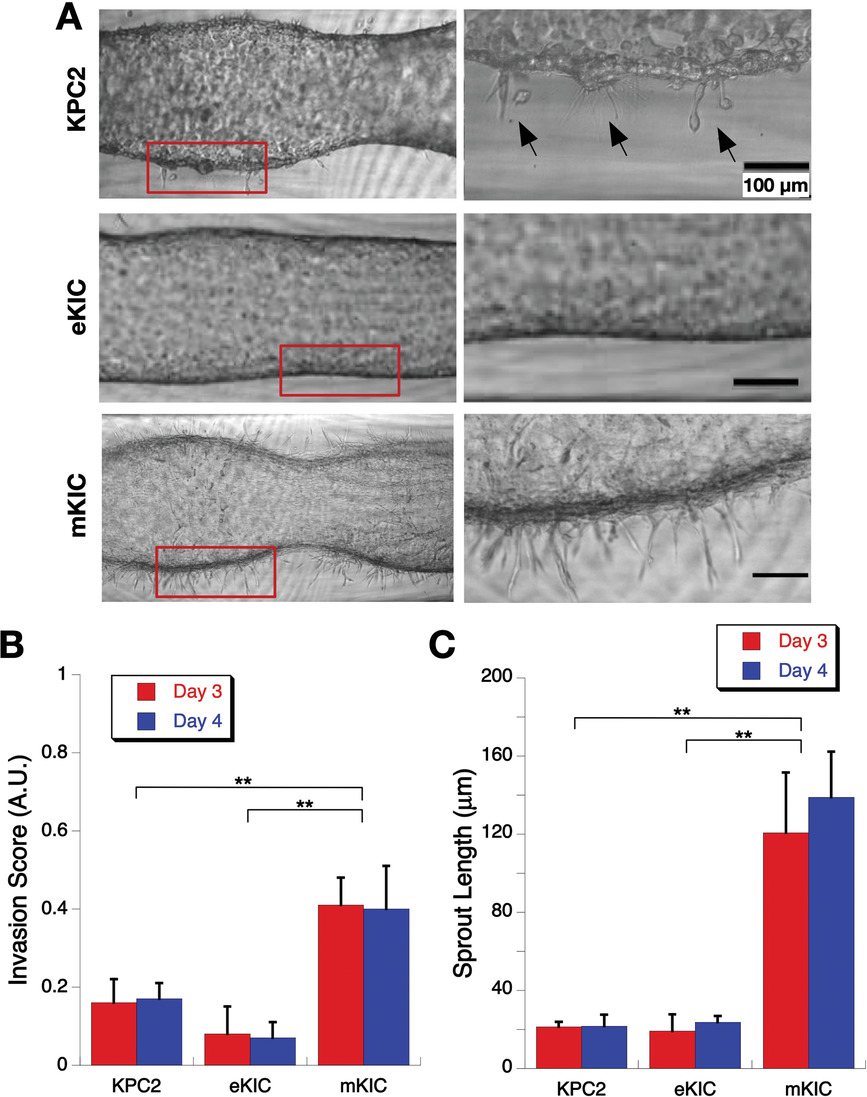
- (A)KPC2、eKIC和mKIC细胞生长和侵袭的显微图。右边显示的是红框区域的放大图像。
- (B)第3天和第4天的侵入分数。mKIC细胞系显示了相对于其他细胞系更高的侵入分数。
- (C)第3天和第4天的平均芽长。同样地,mKIC细胞系显示了相对于其他细胞系更长的芽长。
Figure 5. Confocal micrographs of collective migration of cancer cells

- (A)培养3天的一个mKIC导管的共聚焦显微图,细胞膜染成洋红色,细胞核为蓝色。
- (B)放大的白框区域的共聚焦显微图。箭头表明独立的细胞组成了侵入细胞链。
Figure 6. Enhancement of cancer cell invasion by TGF- β1

- (A)TGF‐β1处理的KPC2和eKIC细胞侵袭的显微图。右边显示的是红框区域的放大图像。
- (B)第3天和第4天的侵入分数。TGF‐β1处理的KPC2和eKIC细胞侵入分数均增加了。
- (C)第3天和第4天的平均芽长。经TGF‐β1处理的平均芽长也增加了。无TGF-β1处理时,KPC2细胞更具侵袭性,而经TGF-β1处理后,eKIC细胞更具侵袭性。
Figure 7. Enhancement of cancer cell invasion by interactions between heterogeneous cancer cells

- (A)共培养模型的侵入显微图。
- (B)第3天和第4天的侵入分数。共培养的KPC2和eKIC细胞侵入分数均增加了。无论单独/共培养,mKIC细胞系的侵入性保持不变。
- (C)平均芽长。
Figure 8. Immunostaining of E-cadherin in mono- and co-culture

- (A)KPC2、eKIC和mKIC单独培养的免疫荧光染色分析。
- (B)KPC2+mKIC和eKIC+mKIC共培养的免疫荧光染色分析。
- (C)E-cadherin表达的倍数变化。这些变化在eKIC+mKIC共培养体系中比KPC2-mKIC共培养体系中更为显著。此前人们认为上皮癌细胞的EMT是由CAF分泌的TGF-β1等生长因子引起的。然而目前的结果表明,还有其他的通过癌细胞之间相互作用的EMT诱导机制。
Discussion
- 同基因型的癌细胞不能模拟真实疾病中的异质性;患者来源的类器官可能会带来异质性,但很难控制和维持患者的时空异质性。
- 其他没有导管结构的模型,包括球状体、类器官和异种移植物,不能提供生物力学微环境,更适合代表疾病的晚期。
- 缺乏CAF和其他基质如透明质酸(HA)、纤连蛋白(fibronectin)和纤维蛋白(fibrin)。
- 仅测试了TGF-β1,其他生长因子如IL-6和EGF没有被测试。
Conclusion
开发了一种新型仿生PDAC肿瘤模型,以模仿肿瘤内异质性的EMT与局部入侵。
Reference
Bradney M J, Venis S M, Yang Y, et al. A Biomimetic Tumor Model of Heterogeneous Invasion in Pancreatic Ductal Adenocarcinoma[J]. Small, 2020, 16(10): 1905500.



