
一种使用器官型肿瘤球体在3-D培养中评估肿瘤-免疫的相互作用的平台。
Introduction
靶向共抑制性免疫检查点(如PD-1和CTLA4)的单克隆抗体已在几种恶性肿瘤中显示出前所未有的临床活性,并正在彻底改变肿瘤医学的实践。通过免疫检查点阻断(ICB)重振抗肿瘤免疫反应,可以产生持久的临床反应,表明有长期的免疫记忆。尽管ICB在黑色素瘤和其他癌症中取得了显著的成功,但克服先天性(原发性)抗药性仍然是一个重大挑战,并且缺乏指导治疗的强大生物标志物。联合免疫疗法或双ICB(抗PD-1+抗CTLA4)已经显示出对转移性黑色素瘤患者的反应率有所提高;然而,这种方法比PD-1单药疗法的生存优势尚未得到证实,而且超过一半的患者经历了治疗方案的显著毒性。目前正在进行临床试验,评估克服先天抗性的“合理”组合策略,但鉴于治疗方法和组合试验越来越多,临床前和临床使用的精确免疫肿瘤学技术和方法的发展需求尚未得到满足。
人们对了解肿瘤和免疫系统之间的动态相互作用越来越感兴趣,这种相互作用影响了使用病人来源的材料对ICB治疗的反应和抵抗;然而,目前缺乏适当的模型系统。目前研究患者抗肿瘤免疫反应的方法受限于全血或血浆的远程测量或活检的静态评估。鉴于肿瘤微环境(TME)在调节T细胞功能,特别是对PD-1阻断的反应方面的新的重要性,需要建立更复杂的肿瘤模型,纳入TME的特征,以阐明反应和抵抗的细胞、分子和免疫学机制。现有的患者来源的癌症模型,包括循环肿瘤细胞(CTC)、类器官培养物和患者来源的异种移植(PDX)可以指导精准的癌症治疗,但需要几周到几个月的时间来生成,并且缺乏原生的肿瘤免疫微环境。保留原生免疫TME的关键特征并进行实时分析的新型体外系统可能会加速预测性和/或预后性生物标志物的识别,促进对抗抗PD-1/PD-L1耐药性的疗法的识别,并推动转化研究工作,最终指导临床中ICB疗法的最佳选择和排序。
在这里,作者描述了一个平台,使用器官型肿瘤球体在3-D培养中评估肿瘤-免疫的相互作用。
此处使用细胞:
MC38:鼠结肠腺癌细胞。
B16F10:黑色素瘤细胞。
CT26:结肠癌细胞。
EMT6:乳腺癌细胞。
The Immune Contexture of the TME Is Preserved in Murine-Derived Organotypic Tumor Spheroids
为了在体外建立ICB模型,作者调整了一个三维微流控装置来短期培养小鼠和病人来源的器官型肿瘤球(MDOTS/PDOTS)。在对新鲜肿瘤标本进行有限的胶原酶消化后,分离出带有自体免疫细胞的多细胞器官型肿瘤球体。
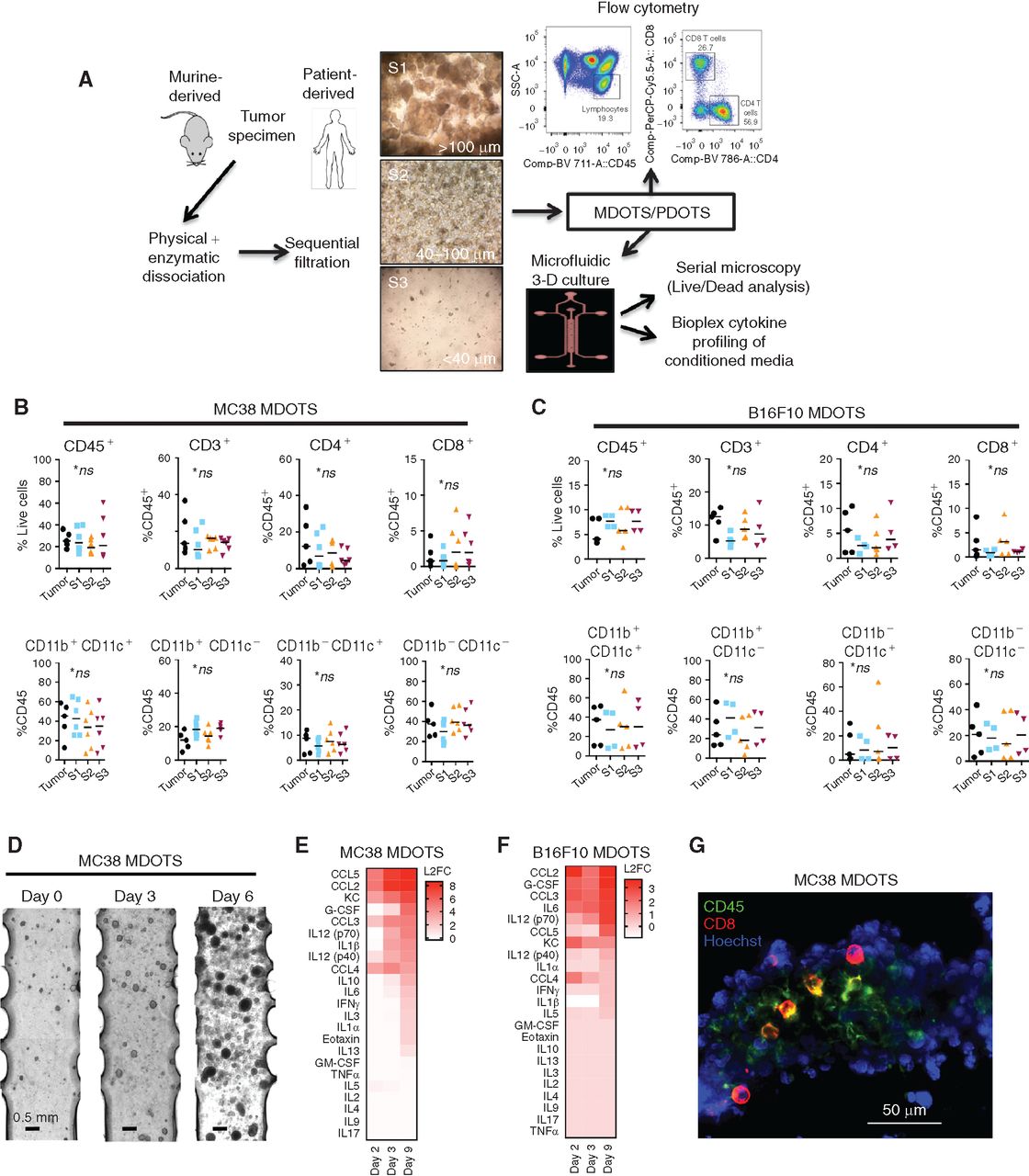
- (A)准备和分析来自鼠或者病人肿瘤样本的MDOTS/PDOTS(S2部分)的示意图。
- (B)通过流式细胞术进行MC38的免疫分析,比较了大块肿瘤以及S1、S2、S3肿瘤球部分。
- (C)通过流式细胞术进行B16F10的免疫分析,比较了大块肿瘤以及S1、S2、S3肿瘤球部分。分析表明,移植肿瘤具有免疫浸润。
- (D)3-D微流控培养的MC38 MDOTS的相差图像(4×)。
- (E-F)来自培养的MC38(E)和B16F10 MDOTS(F)分泌细胞因子谱热图,以相对于第1天的log2变化表示。
- (G)MC38 MDOTS中CD45+和CD8+免疫细胞的免疫荧光染色。表明在装置中保留了含有肿瘤、免疫细胞混合物的肿瘤球。
Murine-Derived Organotypic Tumor Spheroids Recapitulate Sensitivity and Resistance to PD-1 Blockade in Ex Vivo 3-D Microfluidic Culture
为了评估对PD-1阻断的体外反应,用抗PD-1抗体(或同型对照IgG)在设备中处理3天或6天,并使用吖啶橙(AO,活细胞)和碘化丙啶(PI,死细胞)进行双标记反卷积荧光显微镜观察。

- (A)MDOTS活死染色的工作流程示意图。
- (B)同型对照IgG或大鼠抗小鼠PD-1抗体处理后,植入的MC38肿瘤体积(TV)。
- (C)不同剂量的抗PD-1抗体及IgG对照施用后,MC38 MDOTS第0天、第3天和第6天的活/死染色量化。
- (D)缺乏免疫细胞的MC38肿瘤球的±抗PD-1活/死分析。
- (E)B16F10 MDOTS的±抗PD-1活/死分析。显示尽管处理相同,该细胞对抗PD-1治疗不敏感。
- (F)MC38和B16F10 MDOTS第6天±抗PD-1的反卷积荧光显微图像。
- (G)CT26 MDOTS的±抗PD-1活/死分析。显示在中等敏感的CT26模型中,抗PD-1治疗具有适度杀伤力。
- (H)CT26 MDOTS的活/死分析。抗PD-1诱导的CT26 MDOTS杀伤被抗CD8α Ab共处理破坏,证明了对 CD8+T细胞的特定要求。这些数据证明了使用明确定义的小鼠模型在体外再现了PD-1阻断的敏感性和耐药性。
- (I)抗PD-1处理的反应性(R1+R2)和非反应性(NR1+NR2)BALB/c小鼠的肿瘤体积。
- (J)用同型IgG对照或抗PD-1体外处理后,反应性和非反应性小鼠的CT26 MDOTS的活/死分析。综上,从PD-1反应性肿瘤(R1+R2)制备的CT26 MDOTS保留了对PD-1阻断的敏感性,而从PD-1非反应性肿瘤(NR1+NR2)制备的MDOTS保持了对PD-1阻断的抗性。这些结果表明,在体内观察到的肿瘤生长和对ICB的反应的异质性在MDOTS中也得到了保留。
Murine-Derived Organotypic Tumor Spheroids Facilitate Testing of Novel Therapeutic Combinations
由于其对抗PD-1的部分敏感性,作者专注于CT26模型,以确定MDOTS分析是否可以确定克服对PD-1阻断的内在阻力的新型组合疗法。此外作者还注意到CT26 MDOTS的CCL2水平特别高,这是一种与PD-1阻断抗性有关的免疫抑制趋化因子。但只中和CCL2并不能PD-1介导的CT26 MDOTS杀伤作用,表明需要另一种策略来更广泛地抑制TME内的免疫抑制信号,并重新激活T细胞。

- (A)抑制TBK1/IKKε对肿瘤细胞和T细胞产生细胞因子影响的机制。同源的先天免疫信号激酶TBK1和IKKε不仅可以促进自分泌/旁分泌细胞因子信号的传递,而且还可以抑制T细胞的激活,这表明TBK1/IKKε的抑制可以通过多种机制加强对PD-1阻断的肿瘤控制,以克服免疫抑制的TME。
- (B)Cmpd1的结构,及其在HCT116细胞中对TBK1/IKKε的IC50(半抑制浓度)和EC50(半最大效应浓度)。
- (C)用Cmpd1处理的指定酶的IC50值。
- (D)CT26肿瘤球(缺乏免疫细胞)在第1、3和6天±Cmpd1的细胞因子热图,以相对于对照的对数倍变化(L2FC)表示。表Cmpd1可有效阻断CT26肿瘤球的免疫抑制细胞因子的作用。
- (E-F)Cmpd1对人CD4和CD8 T细胞中IL2(E)和IFNγ(F)的剂量响应曲线。表明,Cmpd1可增强纯化的CD4+和CD8+ T细胞的IL2和IFNγ分泌。

- (A-B)用IgG+DMSO/Cmpd1以及αPD-1+DMSO/Cmpd1处理6天后,CT26 MDOTS的活/死染色量化(A)及荧光显微图像(B)。结果表明,体外将Cmpd1加入到PD-1阻断治疗中,增强了对CT26 MDOTS的杀伤力。
- (C)用IgG+Cmpd1、αPD-1或αPD-1+Cmpd1处理的CT26 MDOTS的细胞因子热图,相对于同型对照IgG和空白对照,以L2FC表示。表明其杀伤增强的原因可能与CCL4、CCL3和IL1β的水平下降以及参与激活先天免疫反应的细胞因子(如G-CSF)相关。
- (D-F)IgG+空白、IgG+Cmpd1、αPD-L1+空白和αPD-L1+Cmpd1处理植入的CT26肿瘤体积(D-E)与生存百分比(F)。
为了确定MDOTS分析是否能预测对TBK1/IKKε双重抑制的体内反应,用Cmpd 1±抗PD-L1治疗携带CT26肿瘤的BALB/c小鼠。与MDOTS分析数据一致,与单独使用Cmpd1或抗PD-L1相比,使用Cmpd1+抗PD-L1的肿瘤控制率更高,生存期更长。将CT26重新植入对联合治疗有特殊反应的小鼠体内,显示没有生长,而EMT6植入的肿瘤则正常生长,这表明在用Cmpd1+抗PD-L1治疗的小鼠中诱导了CT26细胞的免疫学记忆。因此,MDOTS分析有效地再现了PD-1阻断±TBK1/IKKε抑制的体内反应,强调了在MDOTS中进行体外筛选以开发联合免疫疗法的潜力。
Immunophenotyping and Secreted Cytokine Profiling Using Patient-Derived Organotypic Tumor Spheroids
接下来,作者通过流式细胞仪对大量PDOTS(n = 40)进行免疫分型,富集对PD-1阻断剂有反应的癌症,如黑色素瘤和梅克尔细胞癌,以建立使用患者来源的肿瘤样本进行体外PDOTS分析的可行性。在PDOTS中一直检测到一系列淋巴细胞(CD19+B细胞、CD4+和CD8+T细胞)和骨髓细胞(CD15+粒细胞、CD14+单核细胞系和CD123+树突状细胞)群。

- (A)PDOTS(S2;n = 40;顶部=%活细胞;底部=%CD45+细胞)的免疫谱分析,按肿瘤类型分组并按%CD8+T细胞排名。,DFCI-13、16、18、21和22代表同一患者的连续胸腔积液样本;*,MGH-04和07是同一患者的连续活检样本;#,DFCI-02和17是同一患者的样本;∧,DFCI-10和29是同一患者的样本;∞,MGH-12和14是一个脑转移患者的连续样本,需要切除并随后再次切除。HNSCC,头颈部鳞状细胞癌。
- (B-C)免疫荧光染色识别非小细胞肺癌(NSCLC)PDOTS中的(B)CD45+免疫细胞和(C)CD8+T细胞与EpCAM+癌细胞。
- (D)S2/S3组分的免疫细胞相关性。
- (E)S2/S3组分的CD4和CD8 T细胞群上的PD-1、CTLA4和TIM3的表达。
作者证实了PDOTS S2和S3组分之间T细胞谱的强相关性,包括抗原刺激(CD45RO+)和耗竭的CD4和CD8 T细胞,以及无论球体尺寸的免疫表型的总体保守性。总之,这些结果证实PDOTS保留了自体免疫细胞,包括关键的肿瘤浸润T淋巴细胞群。

鉴于患者临床反应的时间过程相对于定义明确的同基因型小鼠肿瘤模型更加异质,作者专注于急性细胞因子的产生,以作为早期免疫激活的系统定量测量。
该图反映了第3天的细胞因子热图,其中±抗PD-1(A、B)、±抗CTLA4(C、D)及±抗PD-1+抗CTLA4(E、F),以相对于未治疗的对照的对数2倍变化(L2FC)表示。观察到大多数样本中CCL19和CXCL13的上调情况且CCL19/CXCL13的上调在PD-1+CTLA4双重阻断后很明显。
Cytokine/Chemokine Effectors Identified by PDOTS Profiling and Patterns of Response and Resistance to PD-1 Blockade
为了证实CCL19/CXCL13在接受PD-1阻断治疗的患者中的上调,作者评估了ICB治疗前后黑色素瘤患者的配对活检标本。

- (A-B)通过(A)qRT-PCR和(B)RNA-seq得到抗PD-1治疗时黑色素瘤活检样本的CCL19/CXCL13 mRNA水平相对于PD-1前(L2FC)的表达谱。可得,与PDOTS分析结果一致,在接受PD-1阻断治疗的患者中,CCL19/CXCL13 mRNA表达增加。
- (C)黑色素瘤活检标本(治疗前和治疗中)的免疫特征(ssGSEA),定义了免疫浸润的(A组)和免疫贫乏的肿瘤样本(B组)。发现在接受ICB治疗的患者亚群(A组)中,各种免疫细胞群富集。
- (D-E)CCL19和CXCL13(D)以及它们各自的受体CCR7和CXCR5(E)在指定的几组患者样本中的绝对表达量(RPKM)(A组,免疫浸润;B组,免疫不良)。可见,免疫浸润的样本(A组)中CCL19和CXCL13及其受体的绝对表达明显较高。
- (F)使用皮肤黑色素瘤(SKCM)TCGA数据获得的Kaplan-Meier生存曲线,通过四向排序CCL19/CXCL13的表达绘成。由此可见,在CCL19/CXCL13表达较高的黑色素瘤标本中,患者生存率明显提高。
- (G)皮肤黑色素瘤(SKCM)TCGA中不同表达CCL19和CXCL13的患者集群中的黑色素瘤活检标本(治疗前和治疗中)的免疫特征(ssGSEA)。在黑色素瘤患者中,CCL19和CXCL13的水平都很高,不同的免疫细胞基因集被富集。这些数据证实,CCL19/CXCL13的动态诱导是对PD-1阻断的免疫反应的一个重要特征,这在PDOTS的体外观察中被发现。
- (H)第3天PDOTS抗PD-1诱导的细胞因子热图,按无进展生存期(PFS)排序,并按对抗PD-1治疗的反应(CB,NCB/LTS,或NCB)和样本采集的时间进行注释。在PDOTS中诱导的这些免疫抑制细胞因子/化学因子中,有几个也是最近报道的先天性PD-1抵抗(IPRES)基因表达特征的组成部分,与无反应相关。
这些数据突出了这种检测的潜力,除了ICB后的CCL19/CXCL13诱导外,还能识别与无效的抗肿瘤免疫反应有关的细胞因子变化。总之,这些数据首次证明了使用MDOTS以及PDOTS进行体外功能免疫分析是可行的,并再现了体内对ICB反应和抵抗的关键特征。
CB:Clinical benefit,临床受益。
NCB/LTS:No clinical benefit, but long-term survival,非临床受益但长期生存。
NCB:No clinical benefit,非临床受益。
ssGSEA,即single sample GSEA,单样本基因集富集分析,对于一个基因表达矩阵,ssGSEA首先对样本的所有基因的表达水平进行排序获得其在所有基因中的秩次rank。然后对于输入的基因集,从基因集中寻找表达数据里存在的基因并计数,并将这些基因的表达水平求和。接着基于上述求值,计算通路中每个基因的富集分数,并进一步打乱基因顺序重新计算富集分数,重复一千次,最后根据基因富集分数的分布计算p值整合基因集最终富集分数。
Discussion
各类肿瘤对ICB的临床反应的证据表明,免疫系统在抑制癌症生长方面发挥着根本作用。尽管对ICB治疗的兴趣迅速扩大,但对ICB治疗反应的分子、细胞和免疫学决定因素仍未完全确定,需要有新的疗法和治疗组合来克服对PD-1/PD-L1阻断的耐药性。在这项研究中,作者描述了一种在3-D微流控培养系统中的胶原水凝胶中生长的器官型肿瘤球体的ICB功能评估方法。患者和小鼠来源的肿瘤球状体(MDOTS/PDOTS)保留了相关的肿瘤浸润淋巴细胞和骨髓细胞亚群,并在短期体外培养中对PD-1阻断有反应。使用充分研究的同基因型小鼠肿瘤模型和患者来源的样本,作者再现了体外对PD-1阻断的敏感性和耐受性的特征,提供了第一个证据证明了使用肿瘤细胞和来自切除肿瘤的自体基质和免疫细胞在模拟TME中评估和量化对PD-1阻断的反应的功能检测。
对靶点参与和通路激活的动态评估,可以快速测量评估药物效果,避免了长期体外培养所固有的复杂问题。在MDOTS/PDOTS中测量对PD-1阻断的功能性体外反应的能力比类器官和PDXs具有明显的优势,后者需要几个月的时间来发展,并且缺乏免疫TME的本地特征。MDOTS/PDOTS的三维培养可能提供一个更真实的环境来评估肿瘤-免疫的相互作用。PDOTS/MDOTS中具备明显的基质和免疫成分的多样性和复杂性。CT26肿瘤球和CT26 MDOTS之间的细胞因子谱的差异突出了本地肿瘤浸润免疫细胞的重要性和相关性。而T细胞系或来自健康供体的外周血单核细胞(PBMC)的T细胞在表型和功能上与肿瘤浸润性T细胞不同,没有或低表达免疫检查点。
PDOTS/MDOTS平台也被用来分析分泌的细胞因子和提名ICB的新效应物。从转录组数据推断,CCL19/CXCL13的产生与免疫浸润之间存在着明显的关系。CCL19和CXCL13有助于招募幼稚T细胞和树突状细胞(CCR7+)以及特定B细胞和T细胞亚群(CXCR5+)到慢性炎症部位,以协调体液和细胞介导的适应性抗肿瘤免疫反应。重要的是,CCL19和CXCL13没有直接的细胞毒性活性,而是间接地招募额外的免疫细胞到TME。
尽管MDOTS/PDOTS分析的好处和优势,但也有几个重要的限制:
- MDOTS/PDOTS分析目前仅限于预先存在的肿瘤浸润免疫细胞,不能反映额外的免疫细胞被招募到模型TME。
- 全面评估所有基质和免疫成分目前是不可行的。免疫荧光成像可以一次评估2到4个细胞类型,但需要更全面和敏感的方法(如单细胞RNA-seq)来提供MDOTS/PDOTS的免疫环境随时间演变的更完整的图像。
- 生物物理(如间质流、剪切应力)和代谢参数(如葡萄糖水平、缺氧)对PD-1反应和抵抗的重要性和影响仍不清楚。
对PD-1阻断的耐药性仍然是一个重大挑战,克服免疫抑制和使TME更有利于T细胞浸润和功能的策略正在进行临床前和临床评估。在成功证明MDOTS对PD-1阻断的体外反应后,作者探索了新的治疗组合,通过靶向免疫抑制性细胞因子信号来增强对PD-1阻断的反应。T细胞中TBK1和IKKε的基因缺失会促进T细胞的激活,这表明TBK1/IKKε的药理抑制可以通过抑制免疫抑制性细胞因子/化学因子和重新激活免疫细胞来增强对PD-1阻断的反应。作者证实,在具有免疫抑制性微环境的MDOTS中,TBK1/IKKε的抑制增强了对PD-1阻断的反应,并确立了这种组合在体内的疗效。这些发现证明了体外MDOTS反应和体内反应的一致性,从而突出了体外测试在MDOTS中的巨大潜力,以确定有效的治疗组合来克服对PD-1阻断的内在抵抗。
总之,作者在此提供了第一个证据,证明短期器官型肿瘤球体培养可以模拟对PD-1阻断的反应,并确定对抗耐药性的具体干预措施,鉴于在体内测试大量潜在的组合疗法的挑战,这是一个非常需要的进步。因此,该系统和未来的适应性可能提供一种功能性的精准医学方法,以推动临床转化工作,开发新的组合,最终实现个性化的免疫疗法。
Reference
Jenkins R W, Aref A R, Lizotte P H, et al. Ex Vivo Profiling of PD-1 Blockade Using Organotypic Tumor Spheroids[J]. Cancer Discovery, 2018, 8(2): 196–215.



