
一种基于气动的、多层结构微流控芯片用于三维细胞的药物筛选。
Introduction
前言论述思路:
- 二维培养和三维培养的差别。
- 三维培养更好,但①时间和成本开销更高;②高内涵筛选(HCS)、高通量筛选(HTS)平台在二维培养中已经较为普及,但在三维培养中应用仍需克服。
- 三维模型的限制主要是:
- ①Z轴厚度。凝胶的厚度超出了通常显微镜物镜的焦距,因此需要在不同焦平面上采集一系列的截面图像,使得图像采集、图像数据处理和计算非常耗时。
- ②组成三维模型的软材料(水凝胶和细胞簇)。由于凝胶-液体的粘性张力,多孔板表面形成凹液面,这种不均匀的结构在孔边缘造成一个阴影环,导致图像分析偏差。
- 由于ECM胶和细胞簇软而脆弱,在孔板上进行液体装载和更换时难以操作,而也导致了其低通量,并限制了三维培养下的药物筛选。
- 当前研究现状:
- 产生平坦的ECM gel。
- 缩小ECM gel尺寸大小,微型化的薄凝胶可以提供更可控的药物分子扩散曲线,同样的时间下可以减少消耗并增加通量。
- 微型化和精确制作的凝胶阵列可以解决三维培养细胞中高通量药物筛选分析面临的挑战。微通道的使用可以进一步提高微型三维细胞药物测试系统的性能,因为微通道可以用来形成薄凝胶和处理小体积的溶液和细胞。
- 联合用药可以增强效率并减少用药的毒性,因为相比于单药治疗会有更低的剂量等级。
- 提出多层的芯片策略,具有更小的占用空间以提高通量。
Design and fabrication of the 3D-μCDS device
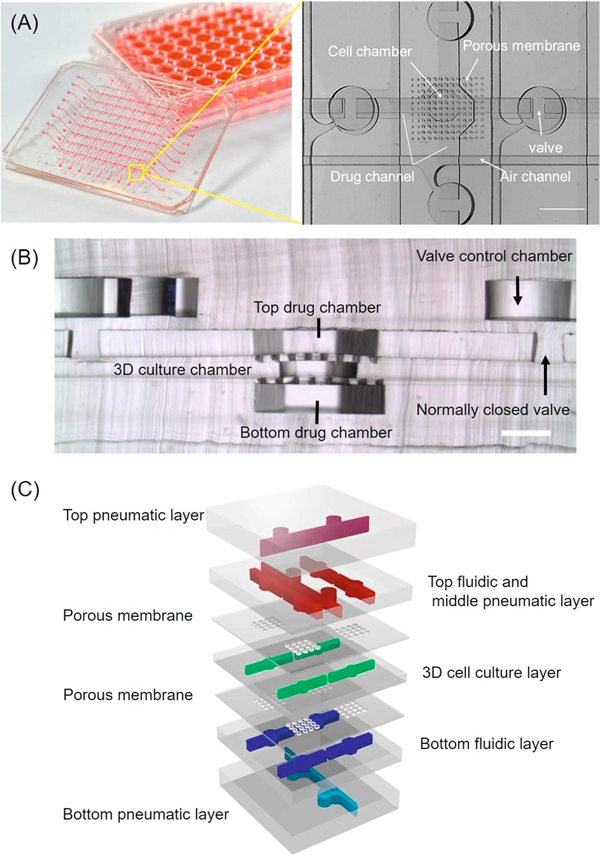
- (A)8×8阵列芯片的照片和一个联合药物测试室的特写。每个测试室都有常闭阀来形成各个单元。气动部分由空气通道网络和常闭阀门上的洞结构组成,每个空气网络通道有一个端口,用于施加负压来控制阀门的开启和关闭。药物测试单元包括一个直径为700 μm的圆形三维细胞培养室,以及两个对角线尺寸为1.2 mm的六边形药物递送室。细胞培养室的顶部和底部被夹在两个多孔膜之间。然后多孔膜与两个交叉重叠的顶部和底部药物通道粘合在一起,完成了一个药物测试单元。
- (B)多层结构的侧视图。
- (C)装置制造过程中组装的各层的示意图,包括两个气动通道层、两个药物通道层、两个多孔膜层和一个细胞通道层。多孔膜上的孔允许培养基或药物溶液同时从顶部和底部通道交换到细胞培养室。如图所示,气动集成的常闭阀作为腔室中的屏障,将每个腔室与相邻单元隔离。
Operation of the 3D-μCDS device
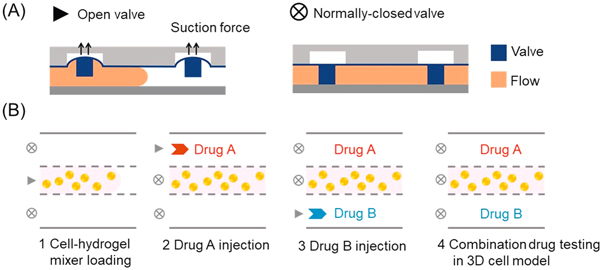
- (A)常闭阀的机理。该设计只需要在装载过程中施加负压,可以很方便的放入传统细胞孵化箱。
- (B)流程图显示了在含有细胞的水凝胶和介质/药物加载步骤中阀门的作用。通过这种微流控方法,可以避免换液及用药时损坏凝胶,保持了每个腔室中凝胶的完整性和一致性。
3D cell culture in thin ECM gels in the microfluidic device for high throughput image assays
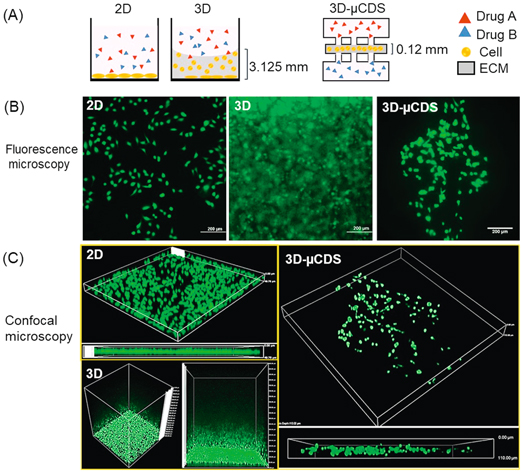
- (A)二维、标准96孔板中的三维细胞培养和微流控设备中的薄胶三维培养的联合药物筛选示意图。标准孔板中会产生厚的凝胶,导致细胞在整个培养基中的分布不均匀,在不同的时间点受到药物的影响也不一样。
- (B)在三种不同的培养模式中,使用荧光显微镜拍摄细胞图像。可以看到由凝胶内聚张力和凝胶厚度引起的弯曲半月板难以用光学显微镜成像。
- (C)共聚焦z-stack图像包含三种不同培养模式的YZ观察面。细胞用钙黄绿素AM标记。与标准96孔板中三维培养的失焦细胞图像相比,3D-μCDS的细胞图像在光学显微镜下更容易解释和量化,每个单细胞的荧光信号都很清晰。薄凝胶也大大减少了多个Z-section图像采集所需的扫描时间。
Characterization of drug diffusion into the thin collagen gel

- (A)通过多柔比星(Dox)扩散动态形成浓度梯度的模拟。在大约360分钟时,药物试验室中达到了平衡药物浓度(即三个室浓度均相等)。
- (B)Dox在3D-μCDS装置中扩散的荧光图像。图像集中在凝胶室顶部靠近顶部多孔膜处。结果与理论模拟的结果一致,测量的强度和模拟的强度都在100分钟左右达到稳定状态。与传统的三维多孔板培养方法相比,药物和凝胶室的小体积允许药物在细胞培养中快速扩散,以达到最终药物浓度。扩散过程也可以通过调整多孔膜的参数来控制,以产生不同的药物浓度曲线来刺激细胞。
- (C)凝胶加载中心室和顶部/底部流体药物通道中选定点的模拟和测量的扩散曲线。结果显示,30分钟后,凝胶室顶部以及凝胶室底部的药物浓度分别达到23.6和19.4 mol m-3,接近于最终的平衡浓度22.1 mol m-3。
3D cell culture in the 3D-μCDS device

- (A)分布在3D-μCDS装置中一排细胞培养通道中的MDA-MB-231细胞的照片;荧光图像:细胞的DNA用Hoechst 33342染色。表明了接种很均匀。
- (B)不同细胞装载密度下每个试药孔室的细胞数量图。注:这里图画错了,趋势画反了。
- (C) 图像显示MDA-MB-231细胞在3D-μCDS装置中培养6天后仍有活力。最初的细胞播种密度为2×106 cells mL-1(左)和5×106 cells mL-1(右)。每天更换培养基,并在第6天用钙黄绿素AM和EthD-1对细胞进行染色。在初始装载密度为2×106 cells mL-1时,培养的细胞保持了较高的细胞活力,即为药物测试实验的最佳初始细胞数。高的细胞密度加载导致了更多的死细胞(可能是由于细胞数量过多的营养不足)。这些结果表明,适当的初始细胞播种密度对3D-μCDS装置中的药物测试至关重要。
Comparison of cancer cell drug sensitivity when cultured using 2D culture, 3D culture, and the 3D-μCDS device
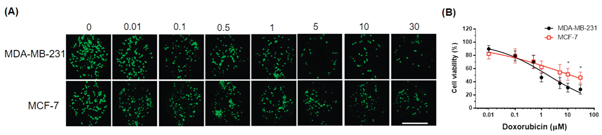
(A)乳腺癌细胞在3D-μCDS装置中暴露于不同浓度的Dox 24小时的荧光图像。
(B)细胞活力的定量分析。结果表明Dox导致两种细胞类型的细胞活力降低,但MDA-MB-231细胞比MCF-7细胞对药物更敏感。
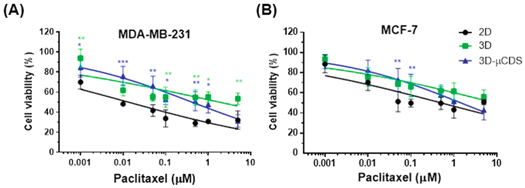
- (A)MDA-MB-231细胞系在二维培养、三维培养和3D-μCDS装置紫杉醇药物测试检测中的生存曲线。
- (B)MCF-7细胞系在二维培养、三维培养和3D-μCDS装置紫杉醇药物测试检测中的生存曲线。结果表明,紫杉醇以剂量依赖性方式抑制二维、三维和3D-μCDS装置培养中两种细胞类型的细胞生长。二维培养的细胞比在三维或设备中培养的细胞对紫杉醇更敏感。注:这里图注写错了,写的Dox。
Table 1. The IC50 (μM) values of the drug test conditions.
| 2D culture | 3D culture | 3D-μCDS | |
|---|---|---|---|
| MDA-MB-231 | 0.013 | 1.848 | 0.418 |
| MCF-7 | 0.5 | 8.78 | 1.45 |
但注意,为了使最终平衡浓度一样,实验者给予的初始药物浓度不一样。表1总结了各处理条件的IC50值。在3D-μCDS装置中对两种测试的细胞类型获得的IC50值都低于孔板,可能是因为这两个系统在三维凝胶中的时间依赖性药物浓度曲线不同。具体来说,3D-μCDS装置要求药物通道中的初始药物浓度是最终平衡药物浓度的2.78倍,而对于传统孔板中的三维培养细胞试验,要求初始装载药物浓度是最终平衡药物浓度的1.22倍。细胞在3D-μCDS装置中接触的初始药物浓度较高,可能是造成微流控装置结果中IC50值较低的原因。
Combinatorial drug screening using the 3D-μCDS device

- (A)在3D-μCDS中,用Dox和紫杉醇(每种药物有8个剂量)联合处理24小时后的MCF-7细胞的代表性荧光显微照片。观察到活细胞数随着药物浓度的增加而减少;当最高浓度的 Dox(30 μM)和紫杉醇(5 μM)组合使用时,几乎没有活细胞残留。
- (B)热图代表测试结果的细胞存活率的平均值。Dox(10 μM)与紫杉醇(0.05 μM)联合使用与单独使用3倍剂量 (30 μM) 的 Dox 具有相同的抑制功效。由于Dox和紫杉醇通过不同的机制产生细胞毒性,因此这些组合在大多数浓度下似乎具有协同作用。
- (C-D)10 μM Dox与各种紫杉醇浓度(C) 和1 μM 紫杉醇与各种Dox浓度(D)的组合指数。这里固定的药物剂量为其IC50值。从C图明显的剂量依赖性减少与D图相比较,表明紫杉醇对MCF-7细胞表现出更高的细胞毒性。
Discussion
优点:
- 平台产生凝胶较薄,需要的成像时间更短。
- 微流控系统避免破坏凝胶,更可控。
- 比多孔板系统更省试剂。
在本研究中,作者证明了96孔板中的三维培养和3D-μCDS阵列在这两个细胞系中的药物反应没有明显的差异,这表明该平台是三维药物筛选的良好模型,但消耗的细胞和试剂更少。此外印证了MDA-MB-231细胞对Dox和紫杉醇都比MCF-7细胞更敏感;MCF-7细胞对抗癌药物更有抵抗力,与以前的研究一致。
机理:
- Dox是一种DNA螺旋嵌入剂和拓扑异构酶II抑制剂,通过嵌入DNA的碱基,阻止mRNA的形成,从而抑制DNA和RNA的合成。
- 紫杉醇在细胞分裂过程中干扰微管解聚。
由于Dox和紫杉醇通过不同的机制作用于细胞毒性,将这两种药物结合起来,在大多数浓度下似乎有协同作用。尽管Dox和紫杉醇的组合被广泛用于乳腺癌的一线化疗,但其心脏毒性是临床实践中的一个重要副作用。利用该微流控设备,能够更详细地筛选各种浓度的药物组合,从而更方便地在类似体内的模型中找到低剂量的最佳药物组合。随着人们越来越认识到联合抗癌药物治疗的潜力,快速和具有成本效益的三维细胞模型方法对药物开发具有相当重要的意义。
Conclusions
开发了一个3D-μCDS阵列装置,可以在上面进行三维癌细胞培养和联合用药测试。
- 由于使用了集成的微通道、多孔膜和微阀,该装置很适合进行规模化的药物测试。3D-μCDS装置可用于进行平行操作,减少操作时间和步骤。
- 该装置具有小型化的三维细胞培养薄凝胶室,使细胞的高内涵(HCS)图像观察变得直接而高效。
- 最后,这种阵列装置允许使用较少的细胞进行组合药物测试,因此,有可能使其成为使用宝贵组织和临床样本的有用工具。
Reference
Chang H-C, Lin C-H, Juang D S, et al. Multilayer architecture microfluidic network array for combinatorial drug testing on 3D-cultured cells[J/OL]. Biofabrication, 2019[2021–08–06].



