
一种动态培养的三维胰岛球模型。
Introduction
思路:
糖尿病(Diabetes mellitus,DM)是一种普遍存在的慢性代谢性疾病。
- 1型DM(Type 1 DM,T1DM)的特点是自身免疫介导的胰岛β细胞的破坏,导致胰岛素的缺乏;
- 2型DM(Type 2 DM,T2DM)的发病机制涉及β细胞功能障碍和胰岛素抵抗,诱发胰岛素分泌受损和胰岛素敏感性下降。
目前,胰岛移植是治疗T1DM的唯一方法,然而存在着供体短缺和胰岛移植存活率低的关键问题。因此有必要保持移植胰岛的高质量,防止胰岛质量的逐渐丧失。在开发治疗T2DM的糖尿病药物方面,药物筛选的主要障碍之一是缺乏能够模拟体内环境生理特征的体外模型。因此,为了确定这两种形式的DM的新治疗方法,越来越需要开发能更充分保留细胞微环境的功能性胰岛体外模型。
- 胰腺中的本地胰岛是由不同类型的内分泌细胞(α、β、δ、PP和ε细胞)聚集而成的,它们在胰岛内通过旁分泌和自分泌的相互作用密切沟通。它们还被一个毛细血管网络所包围,该网络对充足的葡萄糖平衡至关重要。胰岛中的大多数细胞是产生胰岛素的β细胞,它们与内皮细胞相邻,沿血管排列,并通过扩散到间质空间来响应葡萄糖的摄取而释放胰岛素。因此,胰岛不仅通过建立聚合体作为一个功能单元与邻近的细胞相互作用,而且在间质流水平上被灌注包围。
与传统的宏观灌注系统相比,微流控系统具有多功能性、试剂消耗少、效率高的优点。然而,目前胰岛研究中的微流控系统仍不足以进行长期培养,并且在体外胰岛模型工程方面有几个挑战:
- 一个挑战是胰岛的大小差异很大,从50到400 μm不等。大的胰岛会发生中心坏死,导致体外生存能力下降。此外,每个胰岛细胞数量的巨大变化使结果的分析更加复杂;
- 另一个挑战是在目前用于胰岛研究的微流控设备中由流动引起的剪切应力造成的细胞损伤。
作者克服胰岛大小异质性挑战的方法是通过凹形微孔,将单个胰岛细胞重新聚集成小尺寸的胰岛球状体(<150 μm)来设计良好控制的三维(3D)胰岛结构。与大胰岛相比,小胰岛的扩散屏障较低,因此在其中心区域不会受到缺氧的影响。为了创造维持胰岛功能的动态条件,利用微流控系统对胰岛进行体内模拟灌注,该系统提供渗透驱动的低速流动(1.54至5.05 μm/s),可与体内间质流的量级(μm/s)相比。具有扩散/对流平衡的生理性慢流可以防止对细胞的剪切损伤,持续提供氧气和营养供应,延长了胰岛的存活时间。
- 本研究旨在探索微流控芯片中的间质流对三维胰岛模型的影响,使用重新聚集的胰岛球体和凹形微孔阵列与渗透式微泵集成。通过比较2周的静态和动态培养条件,彻底调查了胰岛特性的变化。观察到流动不仅能增强胰岛的健康,还能在体外维持非内分泌细胞,如胰岛内皮细胞(iECs)。
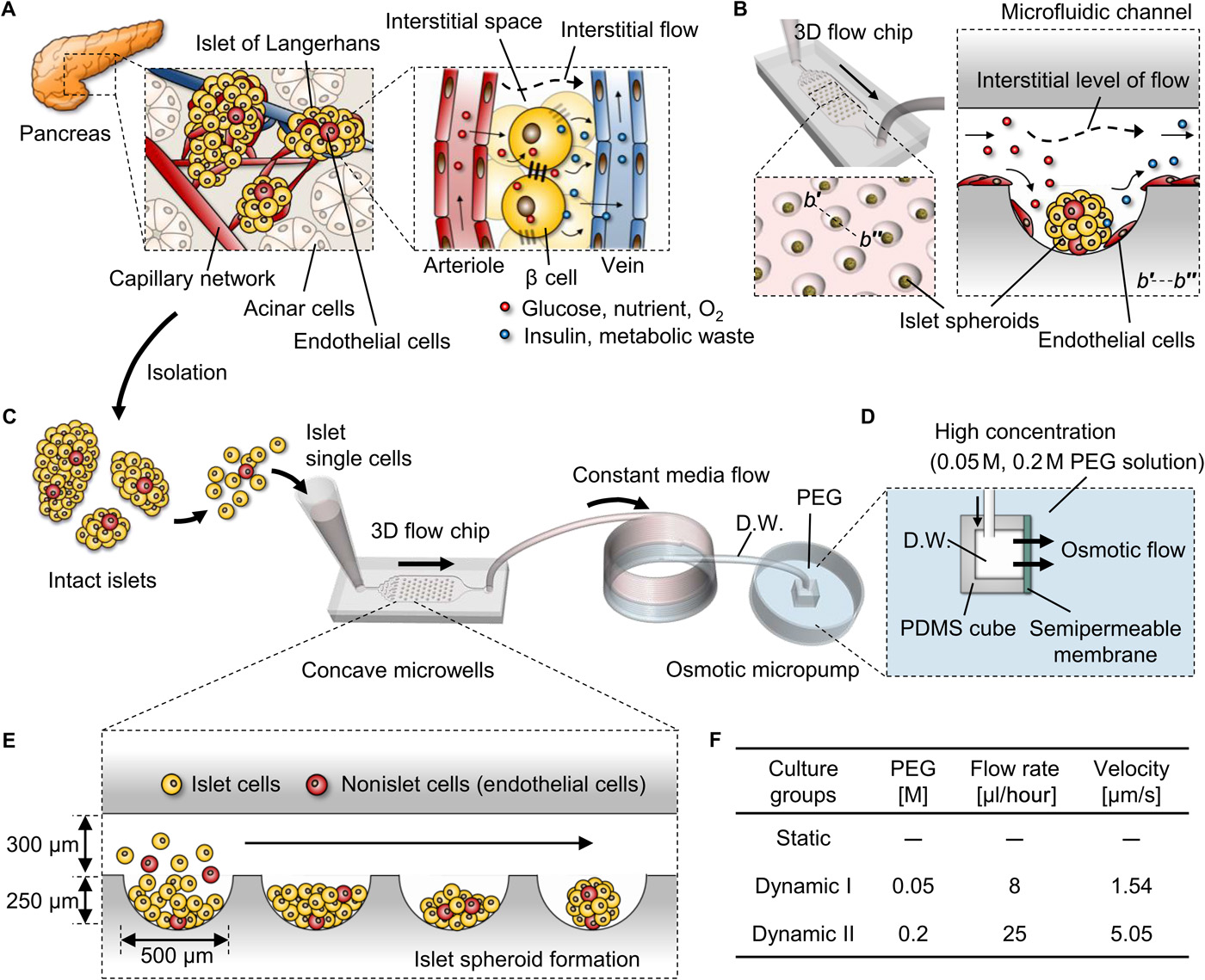
- (A)分散在原生胰腺外分泌小管中的内分泌细胞群形成朗格汉斯岛。胰岛内存在密集的血管网络,通过细胞外空间的扩散和间质水平的流动,促进了有效的营养供应和对葡萄糖刺激的充分反应。生产胰岛素的β细胞通过粘附性连接紧密相连,以协调激素的释放并最大限度地发挥其功能。
- (B)基于微芯片的胰岛球与灌注系统以模仿体内环境。微孔阵列的形状和分布均匀,有利于形成统一大小的球体,增强细胞与细胞之间的相互作用。流动芯片提供连续的营养和氧气供应,并通过间隙水平的缓慢流动清除代谢废物。
- (C-E)实验装置示意图。
- (C)从Sprague-Dawley大鼠分离的完整的胰岛被分散成单个的胰岛细胞,并接种到基于PDMS的微流控芯片的入口处。出口连接到渗透微泵的盘管上。
- (D)将渗透泵浸入聚乙二醇(PEG)溶液,以产生系统的主要驱动力。D.W.,蒸馏水。
- (E)解离的细胞,包括胰岛细胞和iECs聚集并在凹形微孔中形成紧凑的球体。
- (F)胰岛细胞在三种不同的条件下于微流控芯片中培养:(i)无微泵的静态条件;(ii)流速为8 μL/h的动态I条件;(iii)流速为25 μL/h的动态II条件。这两种流体条件(动态I和动态II)都在体内间质流速度的范围内。
Survival of iECs under dynamic culture conditions
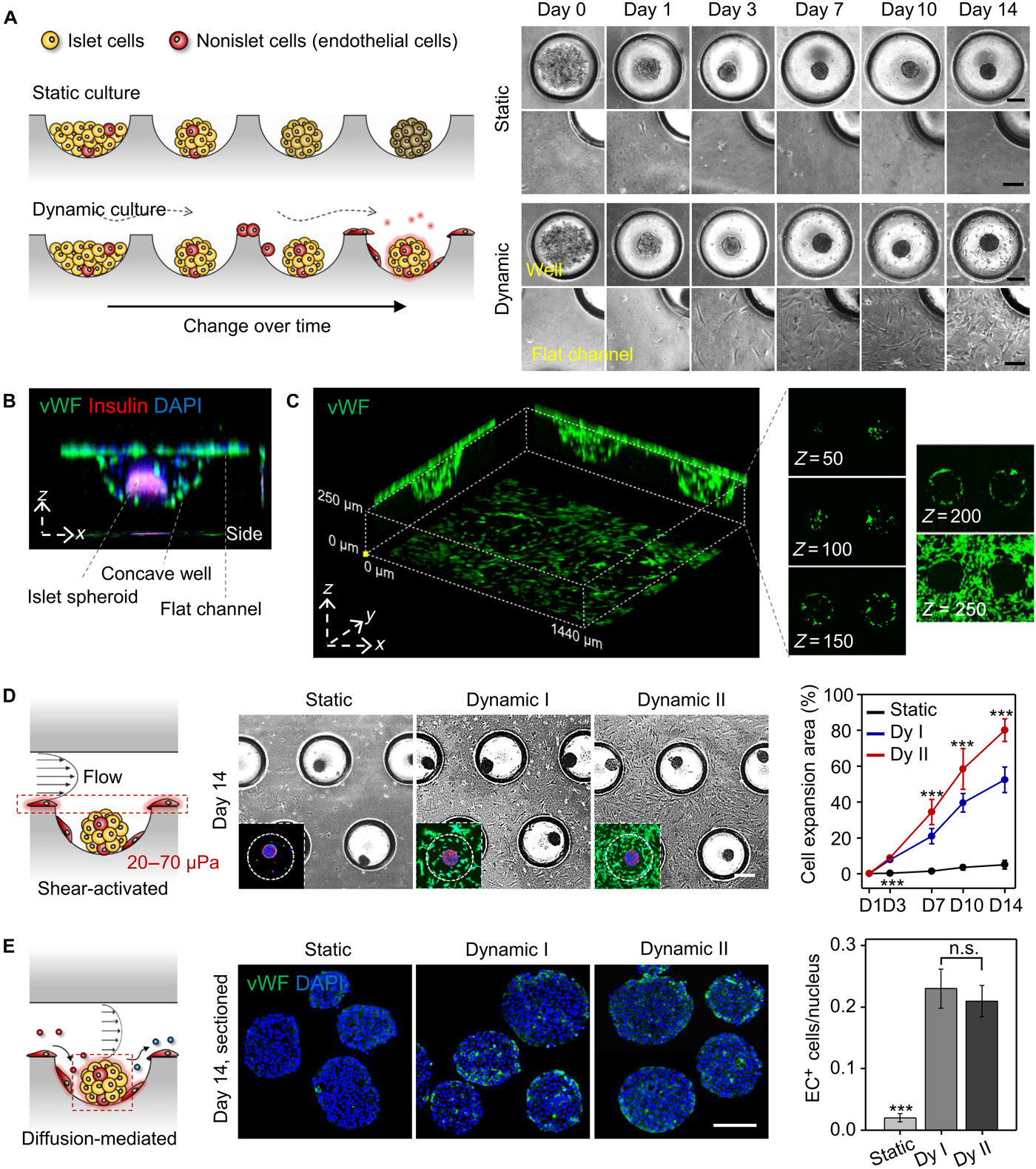
- (A)凹形微孔中的胰岛球的形态,以及在静态或动态培养条件下,iECs的存活时间。
- (B-C)在动态培养下检测iECs的内皮细胞特异性标志物。
- (B)孔内含有iECs的球体XZ图像。显示了胰岛内分泌细胞(胰岛素,红色)、内皮细胞(血管性血友病因子vWF,绿色)和细胞核(DAPI,蓝色)的染色。
- (C)芯片上的iECs(vWF;绿色)的三维投影图像,以及不同Z轴的共聚焦图像。
- (D)通道中因剪切力激活而扩张的iECs。显示了不同培养组(静态、动态I和II)的iECs形态,免疫荧光图像(插图:胰岛素,红色;vWF,绿色;DAPI,蓝色),以及14 d内细胞面积的量化。
- (E)在扩散主导的微环境下,胰岛球内的iECs细胞的存活率。显示了在不同培养条件下培养14 d的胰岛球横截面的免疫染色(vWF,绿色;DAPI,蓝色)。发现两种动态培养条件下iECs数量相当,表明球的表面和内部区域与通道相比是扩散主导的,而不是对流主导的。
Improved viability and function of islet spheroids under dynamic culture conditions

- (A-B)在静态和动态(I和II)条件下,第7 d和第14 d胰岛球体的细胞活力。
- (A)活/死检测显示绿色为活细胞,红色为死细胞。动态组的胰岛球随时间的推移保持高活力,而静态组的球体表面在第14 d出现许多死细胞。
- (B)活性检测结果的量化。量化显示,与静态组相比,动态组的细胞活力在第7 d和第14 d都明显提高。
- (C)定量实时聚合酶链反应(qRT-PCR)分析完整的小鼠胰岛和胰岛球在静态和动态条件下,在14 d的培养过程中的促凋亡基因Fas和Bax,以及抗凋亡基因Bcl-2的表达情况。每组的基因表达是相对于18S rRNA的表达而计算的,并将其归一化为第7 d完整小鼠的水平。体外培养后,所有组别中促凋亡基因Fas和Bax的表达都增加了,而抗凋亡基因Bcl-2的表达则随着时间的推移呈下降趋势。然而,在第14天,Fas和Bax分别在静态组和完整胰岛组中表达得最多,而Bcl-2在完整胰岛中的表达水平最低(减少>10倍),其次是静态组。这证实了动态培养可以提高胰岛的生存能力。
- (D)在静态和动态I和II条件下,微流控装置中的胰岛球体消耗的葡萄糖浓度的数学模拟。假设介质中葡萄糖的初始浓度为11.1 mol/m3,扩散系数为580 μm2/s,消耗率为每秒0.267 mol/m3。静态条件下,葡萄糖在5 h内被消耗完毕。
- (E-F)在第7 d和第14 d对胰岛素和E-钙粘蛋白进行免疫荧光分析。
- (E)不同培养条件下的胰岛球状体的共聚焦z堆叠和横截面图像(胰岛素,红色;E-钙粘蛋白,绿色;DAPI,蓝色)。
- (F)三组中胰岛素或E-钙粘蛋白与细胞核的比例(左图,Z堆叠;右图,切片)。胰岛素蛋白在整个培养期间在动态组中保持高度表达,但在长期静态培养中几乎检测不到,这表明β细胞的去分化。此外,与静态组相比,动态条件下培养的小鼠有更高的E-钙粘蛋白表达,这是介导β细胞之间粘附并影响其胰岛素分泌能力的细胞表面蛋白。
Abundant microvilli and tight cell junctions in islet spheroids under dynamic condition with slower perfusion

- (A、C、E)静态或动态条件下的胰岛球外部和内部的扫描电子显微镜图像。
- (B、D)微绒毛总长度测量。微绒毛是富含F-肌动蛋白的丝状体,位于细胞侧膜,富含葡萄糖转运体Glut2,对β细胞感知葡萄糖有重要作用。放大的表面图像显示,只有流动暴露的胰岛球在第7 d保持丰富的微绒毛(箭头)。2 w后,只有动态I条件下的胰岛球存在细胞-细胞紧密连接,而动态II条件下的胰岛球则失去了紧密连接。在设备中200 μL/h的快速液体流动下,观察到紧密连接和微绒毛的损失。表明动态I条件有助于在长期培养中保持胰岛的形态特征。
Enhanced glucose responsiveness of islet spheroids under dynamic condition with slower perfusion

- (A)低(2.8 mM)和高(16.7 mM)葡萄糖下的胰岛素分泌(GSIS)测定。静态组在暴露于高葡萄糖时释放的胰岛素量要小得多。
- (B)刺激指数(SI)值。在低葡萄糖或高葡萄糖培养1 h后,测量胰岛球对不同葡萄糖浓度的分泌量。SI的计算方法是将高、低葡萄糖下的胰岛素浓度相除。在第7 d和第14 d,动态I组的SI值明显高于动态II组(第14 d分别为7.1±0.3和6.0±0.6),表明动态II条件下的葡萄糖反应下降。结果表明,即使在缓慢的间质流条件下,控制流速对胰岛在灌注培养下改善其功能是很重要的。
Long-term maintenance of pancreatic islets & Application to in vitro testing

- (A)胰岛培养条件的比较。分离的完整胰岛的常规悬浮培养和重组的胰岛球的微流控灌注培养。在下面的实验中,用传统方法培养的胰岛和具有静态和动态I和II的胰岛球在培养7 d和14 d后被取走。培养1 d的新鲜完整胰岛被用作对照。
- (B-E)qRT-PCR分析显示动态培养中的小鼠特异性基因表达较高。(B)β细胞(胰岛素、Pdx1和Glut2);(C)α细胞(胰高血糖素Glucagon);(D)非胰岛细胞包括内皮细胞(Pecam)和神经细胞(Tubb3)以及(E)胰岛ECM蛋白(胶原IV和I)的基因表达。
- (F-G)使用(F)甲苯磺丁脲和(G)GLP-1的不同剂量,在第7 d对胰岛球状体进行药效测试。甲苯磺丁脲以剂量依赖的方式刺激动态组的胰岛素分泌,在动态组和第1 d的胰岛组中,浓度为100 μM时获得最大值。然而,在第7 d胰岛组和静态组中,对其没有明显反应。GLP-1也呈现类似趋势。因此细胞球培养,特别是在动态条件下,提高了对测试药物反应的敏感性,其胰岛素释放模式与体内观察到的模式相似。
- (H-I)在静态或动态条件下,用含有不同浓度(0、200和400 nM)雷帕霉素(一种免疫抑制剂被用于胰岛移植)的培养基,在第7 d对胰岛球进行药物毒性评估。
- (H)胰岛活性(活细胞,绿色;死细胞,红色)。
- (I)药物暴露4 d后的葡萄糖反应性。量化的存活率结果以折线形式表示。以上结果共同证实,模仿间质流的动态条件下培养的功能性胰岛可以用于体外药物测试,比传统方法培养的胰岛具有更好的敏感性和可预测性。
Discussion
在体外培养过程中,由于胰岛微环境的破坏,来自正常胰腺的分离的完整胰岛会逐渐失去其完整性、活力和功能。许多研究都集中在促进血管化的生长因子或支持性细胞的加入,以应用于胰岛移植。虽然有许多关于三维胰岛模型的微观工程方法的研究,以更好地模仿体内的胰岛环境,但只有少数研究探讨了流动的影响。一个动态的体外模型可以更准确地复制体内的生理线索和胰岛的生理活动。
已有研究表明,通过使用生物反应器系统,灌注式三维培养的胰岛在体外保持了胰岛的活力和功能7天。但目前的研究都没有考虑对周边细胞的潜在剪切损伤,这可能会损害正常的胰岛结构和体外功能。作者目前的研究是为了在优化的动态培养条件下建立一个统一的、尺寸可控的胰岛微组织,使生理性的氧气梯度和营养物质通过间质流供应,以实现有效的胰岛培养。
作者观察到:
- 与静态条件相比,微流控系统中的胰岛功能有所改善与支持胰岛稳定性和功能的微观结构也得到了很好的维护;
- 当作者用注射器泵产生的快速液流(200 μL/h)下培养胰岛球时,,胰岛形态和功能的维持明显好于静态培养下,但不如较慢的动态培养组,表明较高的液体剪切力导致细胞损伤。
- 影响胰岛功能和生存能力的另一个可能因素是iECs的生存。在胰岛内,β细胞不直接形成ECM,而是依靠iECs来合成它们的基底膜。ECM是胰岛细胞微环境的一个重要组成部分,因为它通过β细胞表面的β1-整合素促进β细胞的生存和功能。在动态条件下培养的胰岛球状体中,ECM的含量最为丰富。动态培养条件可提高胰岛球中的iEC存活率,当iECs离开胰岛球状体时,由于流动引起的剪切应力,它们在凹孔和微流控通道的表面积极迁移和扩增。
- 与静态和传统模型相比,动态条件下的胰岛球模型对药物的敏感性更高。
Reference
Jun Y, Lee J, Choi S, et al. In vivo–mimicking microfluidic perfusion culture of pancreatic islet spheroids[J]. Science Advances, 2019, 5(11): eaax4520.



