
一种可扩展、高通量的药物组合筛选芯片平台。
Introduction
思路:
精准癌症治疗旨在根据个体病例定制适当的治疗方案。因此需要将患者癌细胞在体外培养并接受多种药物处理,作为个体患者的治疗指导。
与单一药物治疗相比,联合用药治疗已成为许多疾病的治疗方法,但由此产生的实验复杂性和成本呈指数级增加,传统的孔板平台已经无法适用于当下需求。
微流控技术以其处理小样本和高通量检测的高度多路复用操作能力,已成为临床精准医学和工业规模药物发现的有前途的技术 。在生成药物浓度梯度方面:
- 先前的微流控高通量药物筛选平台引入了“圣诞树结构”以产生线性药物浓度梯度,但它们仅限于两种药物的组合,可能无法满足高通量药物筛选的需要。
- 由于细胞以非线性方式响应不同的药物浓度,在某些情况下药物筛选实验需要测试几个数量级的剂量来计算50%抑制浓度(IC50),因此产生对数浓度梯度是非常有必要的。
此外,3D细胞培养系统已被广泛用作模拟体内肿瘤微环境的更好模型,并且在药物筛选研究中越来越受欢迎。
作者报告了一种可扩展、易于处理、高通量的药物联合筛选方案,结合定制软件进行药效读出和数据分析。所提出的微流体设计能够从任意数量的不同药物中筛选所有可能的成对药物组合。作为概念验证,作者展示了具有对数浓度梯度的8种药物筛选芯片,并对多个细胞系进行了药物组合筛选实验。
Microfluidic Filter Structure for Cell Capture and Sphere Formation
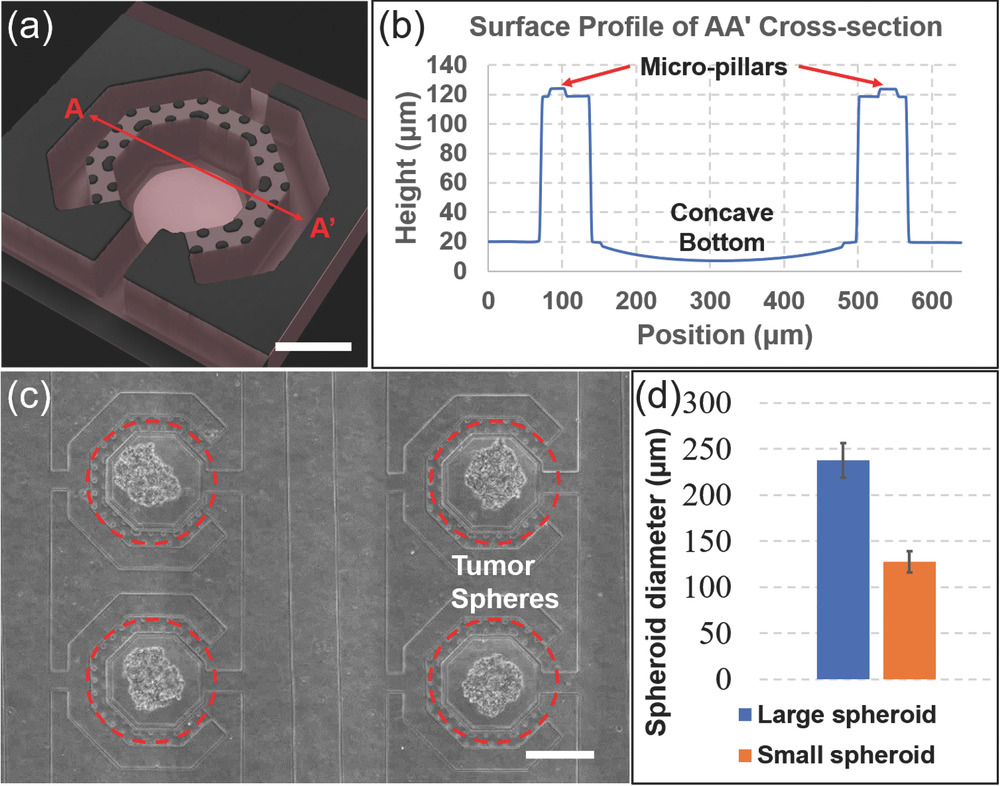
- (a)一个单元的激光共聚焦显微镜图像。细胞在由微柱支撑的5 µm间隙处捕获。
- (b)用Olympus OLS 4000 LEXT测量的细胞球培养室横截面轮廓,凹底深度为16 µm。
- (c)在培养室中形成的SUM159乳腺肿瘤球的白光图像。
- (d)在培养室中形成的肿瘤球的尺寸分布。
Microfluidic Tree Structure as Logarithmic Concentration Gradient Generator
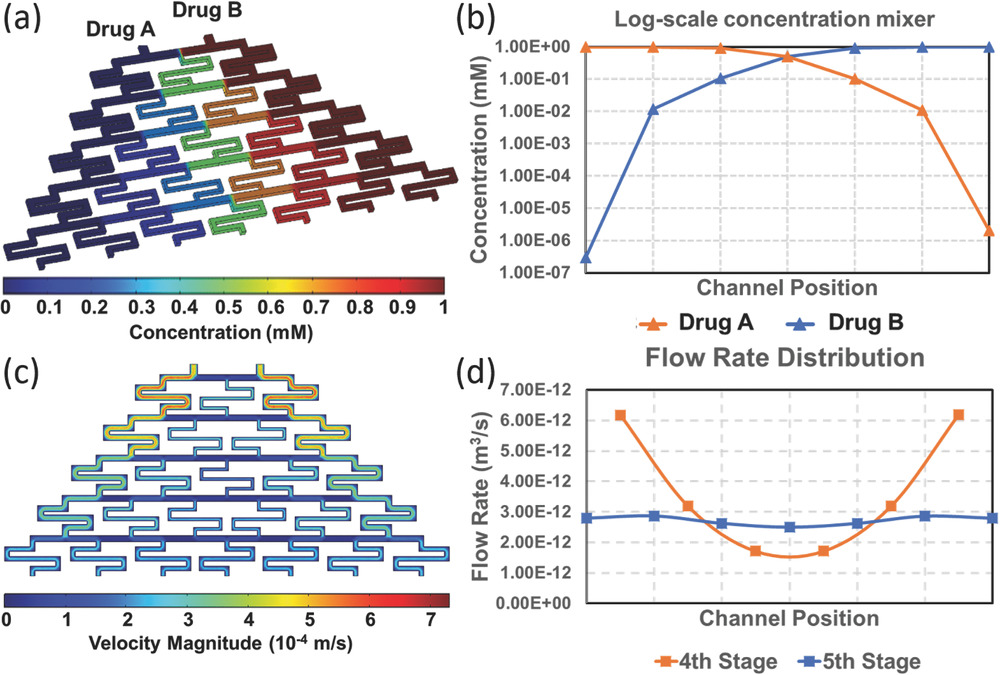
- (a)使用COMSOL对“圣诞树混合器”进行浓度模拟。含有两种不同化合物的溶液从顶部入口引入并流过微通道网络。流体在每个分支通道阶段合并,产生不同成分的混合物,然后分流到下一个阶段。最后,在分支通道的最后一级产生浓度梯度。每一级的分流比由流动阻力决定。根据Hagen-Poiseuille方程,通道的水阻力与通道宽度的平方近似成反比。
- 当所有流体通道设计为相同尺寸(宽度、高度、长度)时,通过所有通道的流动阻力分支渠道是一样的。这种情况下,将在最后阶段建立具有等差级数比的线性浓度梯度;
- 为了产生非线性浓度梯度,左右两侧的通道设计得比中心的通道宽,使两侧曲流通道的流动阻力小于中心通道的流动阻力。这样大部分流动将被引导到侧通道,而只有一小部分在中心曲折通道处相互混合。以图2a所示,两种药物化合物A和 B加载在混合器的两侧。由于与中心通道相比,侧通道的流动阻力较小,在这种情况下,当前一阶段的混合物流向下一阶段时,左侧通道中的大量化合物A与中央通道中的少量混合物A+B合并,产生的混合物主要含有A与B的一小部分。体积差异越大;最终混合物中化合物B的含量越少,化合物A与化合物B的浓度比越大。通过这种方式可以生成对数浓度梯度。
- (b)在混合器的最后阶段测量药物A和药物B的浓度。
- (c)使用COMSOL对“圣诞树混合器”进行速度模拟。该芯片的另一个关键设计是混合器阵列最后一级(即第五级)的曲折通道具有相同的尺寸,而不是遵循之前描述的“侧通道比中心通道宽”的规则。最后阶段曲折通道用作上游“圣诞树混合器”和下游细胞球培养室之间的“缓冲层”。最后一级曲流通道设计背后的基本原理是,连接到下游的细胞球培养室也有助于“圣诞树混合器”最后一级的等效阻力。即使最后一级的通道尺寸经过精心设计,由于下游微流体结构的水力阻力的贡献,前一级看到的等效阻力也会受到影响。另一方面,“圣诞树混合器”对细胞捕获结构的流动阻力也有影响。当细胞从细胞入口加载到细胞培养室时,“圣诞树混合器”的不平衡通道设计也会影响细胞加载的均匀性,导致更多的细胞加载到连接到侧通道的室中,因为流动阻力较低。在“圣诞树混合器”的最后阶段,相同尺寸的通道有助于平衡细胞负载并在所有分支之间形成大小均匀的肿瘤球。
- (d)对第4级和第5级(末级)通道进行流量测量,验证末级可以作为“缓冲层”来平衡支路之间的流量。
Mixer Array and Drug Inlets “Sudoku Puzzle
Table 1. Example drug inlets layout for 4 drugs. Number 1,2,3,4 stands for 4 different drugs
| 1 | 2 | 3 | 4 |
|---|---|---|---|
| 2 | 4 | 1 | 3 |
通过部署“圣诞树混合器”结构可以在两种药物之间产生浓度梯度。然而假设8种药物的进行组合需要使用“圣诞树混合器”并排筛选,至少要部署28×2=56个药物入口,这需要非常复杂的微流控系统。为了解决这个问题,相邻的圣诞树混合器设计为共享一个共同的药物入口。然而,这种设计需要对入口阵列进行特殊布置,以保证相邻的药物对覆盖所有可能的组合。如果有4种药物,可以按表1所示排列药物入口。其中,数字1-4代表4种不同的药物,每个数字对之间有一个“圣诞树混合器”以产生浓度梯度。在这种情况下,所有可能的成对组合1-2、2-3、3-4、1-3、2-4 和 1-4都被覆盖。
Table 2. Example drug inlets layout for 16 drugs. Number 1–16 stands for 16 different drugs
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 4 | 1 | 6 | 3 | 8 | 5 | 10 | 7 | 12 | 9 | 14 | 11 | 16 | 13 | 15 |
| 3 | 1 | 5 | 2 | 7 | 4 | 9 | 6 | 11 | 8 | 13 | 10 | 15 | 12 | 16 | 14 |
| 4 | 6 | 2 | 8 | 1 | 10 | 3 | 12 | 5 | 14 | 7 | 16 | 9 | 15 | 11 | 13 |
| 5 | 3 | 7 | 1 | 9 | 2 | 11 | 4 | 13 | 6 | 15 | 8 | 16 | 10 | 14 | 12 |
| 6 | 8 | 4 | 10 | 2 | 12 | 1 | 14 | 3 | 16 | 5 | 15 | 7 | 13 | 9 | 11 |
| 7 | 5 | 9 | 3 | 11 | 1 | 13 | 2 | 15 | 4 | 16 | 6 | 14 | 8 | 12 | 10 |
| 8 | 10 | 6 | 12 | 4 | 14 | 2 | 16 | 1 | 15 | 3 | 13 | 5 | 11 | 7 | 9 |
然而,当药物数量变大时,排列问题变得更加复杂,例如,当药物数量达到16时,计算复杂度可能达到1026种可能的排列。为了使放大成为可能,入口的一般解决方案需要安排,以便相同的设计策略可以应用于任意数量的药物。尽管有许多可能的解决方案可以满足要求,但作者找到了适用于所有偶数药物的通用解决方案。为了方便解释,他们将入口排列问题改写为以下“数独难题”问题。由于所有的要求都是对邻接关系提出的,引入一个“邻接关系矩阵”来记录现有的邻接数非常方便。通过填写“邻接关系矩阵”的一些规则,并在“数独谜题”的相应条目中放入某些数字,能够解决任意偶数的“数独谜题”。作为演示展示了16种药物的矩阵。
Multiple PDMS Layers for Drug Mixing and Routing

- (a)三个PDMS层的单独视图。使用6 mm活检打孔器在药物入口的所有三个PDMS层上打出32个孔,连接混合层和路由层。
- (b)混合层俯视图:32个入口分配给8个药物,一组4个在路由层中以相同的编号相互连接。在药物处理之前,细胞被加载到入口并自动部署到由重力流驱动的1032个培养室中。细胞入口也用于药物处理过程中的药物出口。
- (c) 路由层的俯视图,不同行上的相同编号在路由层中连接。
Validation of Logarithmic Concentration Gradient On-Chip
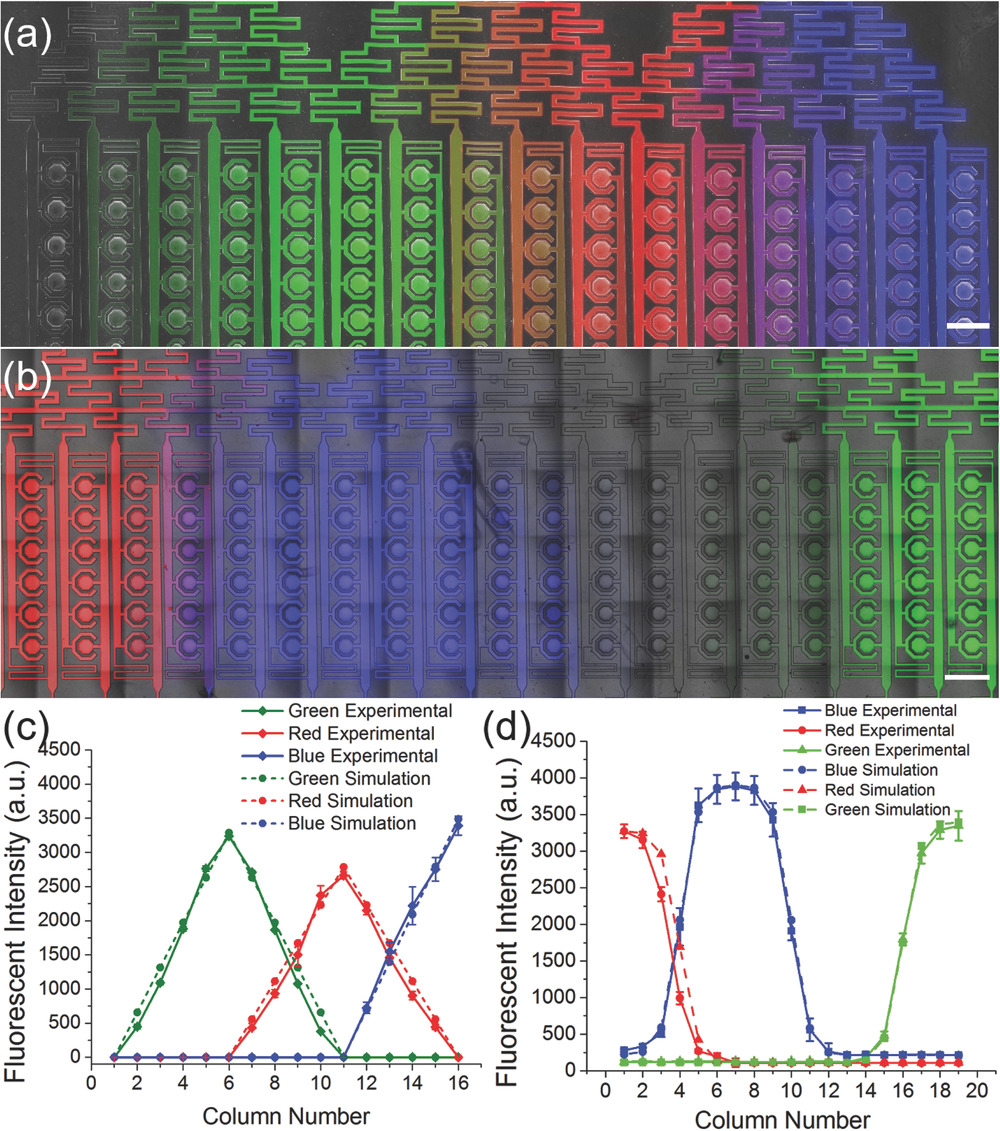
- (a)使用PBS、荧光素(绿色)、四甲基罗丹明(红色)和DAPI(蓝色)从左到右生成线性梯度。最终图像是由白光、FITC、TRITC和DAPI通道的重叠图像创建的。
- (b)使用四甲基罗丹明(红色)、DAPI(蓝色)、PBS和荧光素(绿色)从左到右生成对数梯度。最终图像由白光、FITC、TRITC和DAPI通道的重叠图像创建。
- (c)线性梯度产生实验(实线)和模拟结果(虚线)之间的荧光强度比较。
- (d)对数梯度生成实验的荧光强度测量(实线),与模拟(虚线)有很好的相关性。 对于对数梯度发生器,由于相机的动态范围和检测分辨率之间的权衡,需要不同的曝光时间来分别验证高浓度区域和低浓度区域。以短曝光时间(30 ms)拍摄一张图像,以实现更大的检测范围并避免荧光饱和,从而可以验证10%、50%和90%之间的浓度关系。
Cancer Cell Loading and Sphere Formation
出于细胞负载平衡考虑,左侧和右侧都使用了两个细胞入口。在加载过程中,500 µL细胞悬液被加载到两个细胞加载入口,而 32个药物入口留空,用作出口。在细胞加载入口和药物加载入口之间的压力差的驱动下,细胞被分配到1032个球形培养室中,并在每个单独的室中的5 µm间隙处捕获。腔室底部设计为弯曲的,因此细胞最终聚集在中央八角形腔室的圆形底部,该腔室涂有 Pluronic-108。细胞培养1 d后,细胞形成大小均匀的球体。通过调节腔室尺寸,能够控制细胞培养间隙的等效流动阻力。腔室尺寸越大,流阻越小。结果,在细胞捕获间隙处捕获的细胞越多,最终形成的球体就越大。作为演示展示了两种不同尺寸的球体(大球:直径238±16 µm,小球:直径124±11 µm),具有两种不同的腔室尺寸设计(大腔室:对角线长440 µm,小室:对角线长240 µm)。
Drug Combination Screening on Breast and Pancreatic Cancer Cell Lines
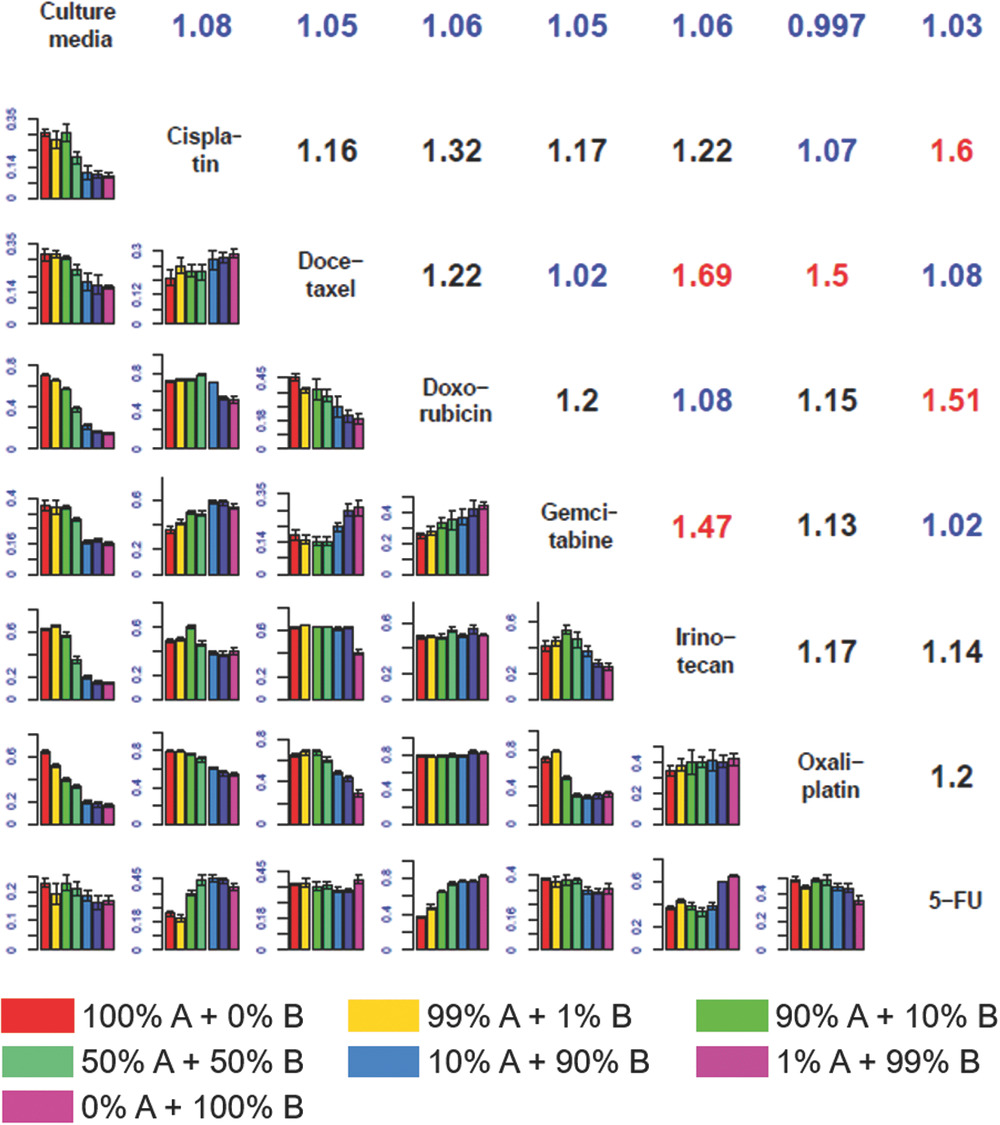
使用胰腺癌细胞系MIA PaCa-2对对照(培养基)和7种药物(顺铂Cisplatin、多西他赛Docetaxel、多柔比星/阿霉素Doxorubicin、吉西他滨Gemcitabine、伊立替康Irinotecan、奥沙利铂Oxaliplatin、5-氟尿嘧啶5-FU)的药物组合筛选结果。下三角表中的每个子图说明了每个相应行和列的药物组合下的细胞死亡率。每个不同颜色的条形代表某种药物组合的不同浓度混合比。 “最大协同指数”(MSI)在上三角表中表示,它由所有筛选的药物对之间的混合比中的最大协同指数定义。具有高MSI(>1.4)的协同药物组合对以红色突出显示,而那些具有低 MSI(<1.1)的非协同药物组合对以蓝色突出显示。
Drug Combination Screening on Pancreatic Cancer Patient-Derived Xenograft (PDX) Cell Line
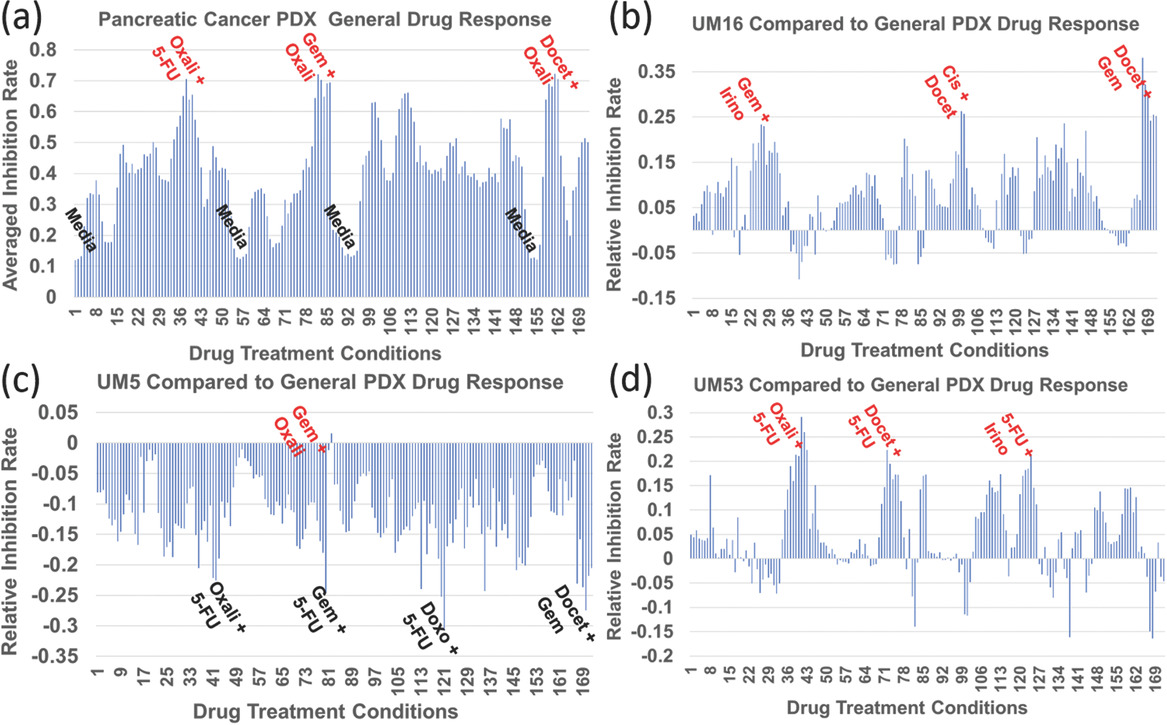
- (a)使用胰腺癌PDX细胞的对照(培养基)和7种药物(顺铂Cisplatin、多西他赛Docetaxel、多柔比星/阿霉素Doxorubicin、吉西他滨Gemcitabine、伊立替康Irinotecan、奥沙利铂Oxaliplatin、5-氟尿嘧啶5-FU)的药物组合筛选结果。X轴列出了172种不同混合比例的不同成对药物组合。 图a反映了172种不同药物治疗条件下所有PDX细胞的平均药物反应。在所有药物组合中,有少数平均抑制率较高的药物,如氟尿嘧啶+奥沙利铂、吉西他滨+奥沙利铂、多西他赛+奥沙利铂等,被认为是治疗胰腺癌普遍有效的药物组合。事实上,氟尿嘧啶+奥沙利铂和吉西他滨+奥沙利铂均已获得美国食品和药物管理局(FDA)批准用于胰腺癌联合治疗。
- (b)UM16相对药物反应与所有PDX细胞的平均药物反应相比。对于UM16,没有一种广为接受的药物组合对抑制细胞生长有效。然而,吉西他滨和多西他赛的非常规组合取得了良好的药效。
- (c)UM5相对药物反应与所有PDX细胞的平均药物反应相比。除了10%吉西他滨和90%奥沙利铂的组合外,UM5对大多数药物化合物均表现出耐药性。
- (d)UM53相对药物反应与所有PDX细胞的平均药物反应相比。不同患者样本之间的异质药物反应证实了为每个人定制个性化化疗的重要性。使用PDX细胞系成功的组合药物筛选实验表明了所提出的平台在发现新的组合和精准医学方面的潜力。
Conclusion
发展了一种高通量多重药物组合筛选平台方案。使用三层PDMS结构、进药口共享方案和特殊布置的进药口阵列,成功地证明了扩大组合药物筛选更多药物的可行性;
提出了一种对数浓度梯度发生器,与线性梯度发生器相比,它提供了更宽的动态浓度范围;
采用3D肿瘤球模型进行药物筛选,以更好地模拟体内肿瘤微环境。具有5 µm细胞捕获间隙、微柱阵列和圆底结构的球体培养室设计保证了238±16 µm大小的均匀球体的形成;
使用胰腺癌细胞系MIA-PaCa-2进行药物筛选实验,确定了多西他赛+伊立替康、多柔比星+5-FU、多西他赛+奥沙利铂、吉西他滨+伊立替康的协同作用,与临床试验结果吻合较好;
使用PDX细胞系进一步验证了制造芯片在精准医疗中的应用,更好地模拟了患者的药物反应。
Reference
Zhang Z, Chen Y-C, Urs S, et al. Scalable Multiplexed Drug-Combination Screening Platforms Using 3D Microtumor Model for Precision Medicine[J]. Small, 2018, 14(42): 1703617.



