
一种声学组装的患者衍生细胞簇(APCCs),保留了原始肿瘤/免疫细胞组成。
Introduction
思路:
免疫逃逸是癌症的新兴标志之一。 免疫抑制细胞如髓源性抑制细胞(MDSCs)协调局部代谢和细胞因子环境,以抑制抗肿瘤免疫并促进肿瘤生长。反过来,肿瘤细胞主动重编程浸润的免疫细胞并诱导肿瘤微环境(TME)特异性免疫抑制表型,例如通过产生一氧化氮(NO)和精氨酸酶-1(ARG-1)抑制T细胞介导的细胞毒性。临床上,更多的MDSCs通常与对免疫检查点抑制剂(ICI)治疗的耐药性有关。此外在动物研究中,靶向MDSCs可以克服肿瘤对ICI的耐药性。
目前由于其极短的寿命(≈1~2 d),体外研究人类肿瘤诱导的MDSC功能和药物反应仍然是一个巨大的挑战。一旦脱离TME的背景,肿瘤诱导的MDSCs的关键表型(如NO和ARG-1的产生)就会迅速减弱或丧失。
- 基因工程人源化小鼠模型可能会重现人类MDSC在体内发挥作用,但它们不能完全反映个体患者的特定遗传和肿瘤异质性;
- 尽管部分保留了TME成分,但在1~4 w的培养室中,患者来源的肿瘤类器官或肿瘤节段的器官型培养物可能会缺乏关键的TME成分如MDSCs;
- 器官型肿瘤培养物在每个肿瘤切片/节段内具有随机分布的免疫细胞,因此妨碍了并行进行多种药物治疗的可比评估。
因此,需要开发能够保存敏感的TME免疫细胞类型(例如MDSCs)并能够对多种药物治疗进行大规模并行分析的患者衍生肿瘤模型。
作者提出了新的声学组装的患者衍生细胞簇(APCCs),用于保存原始肿瘤和免疫细胞组成,模拟它们在3D微环境中的相互作用,并测试患者原发性肿瘤的治疗反应。
通过结合声学细胞组装和基质胶固定,可以使用原发性患者肿瘤消化物生成和操作超过100个具有统一细胞组成和数量的APCCs。他们证明:
- APCCs保留了MDSCs的活力和功能表型,包括它们的关键免疫抑制基因的表达,抑制T细胞介导的细胞毒性以及抑制促炎细胞因子分泌;
- APCCs用于测试MDSCs靶向多激酶抑制剂卡博替尼(cabozantinib)和抗PD1药物派姆单抗(pembrolizumab)的联合治疗效果。通过卡博替尼治疗抑制MDSCs,发现抗PD1对肾细胞癌(RCC)患者原发性肿瘤的抗肿瘤作用增强了123 ± 67%。
因此,证明该方法可广泛应用于以快速、可扩展和可重复的方式研究离体肿瘤免疫。
Rapid Formation of Acoustically Assembled Patient-Derived Cell Clusters
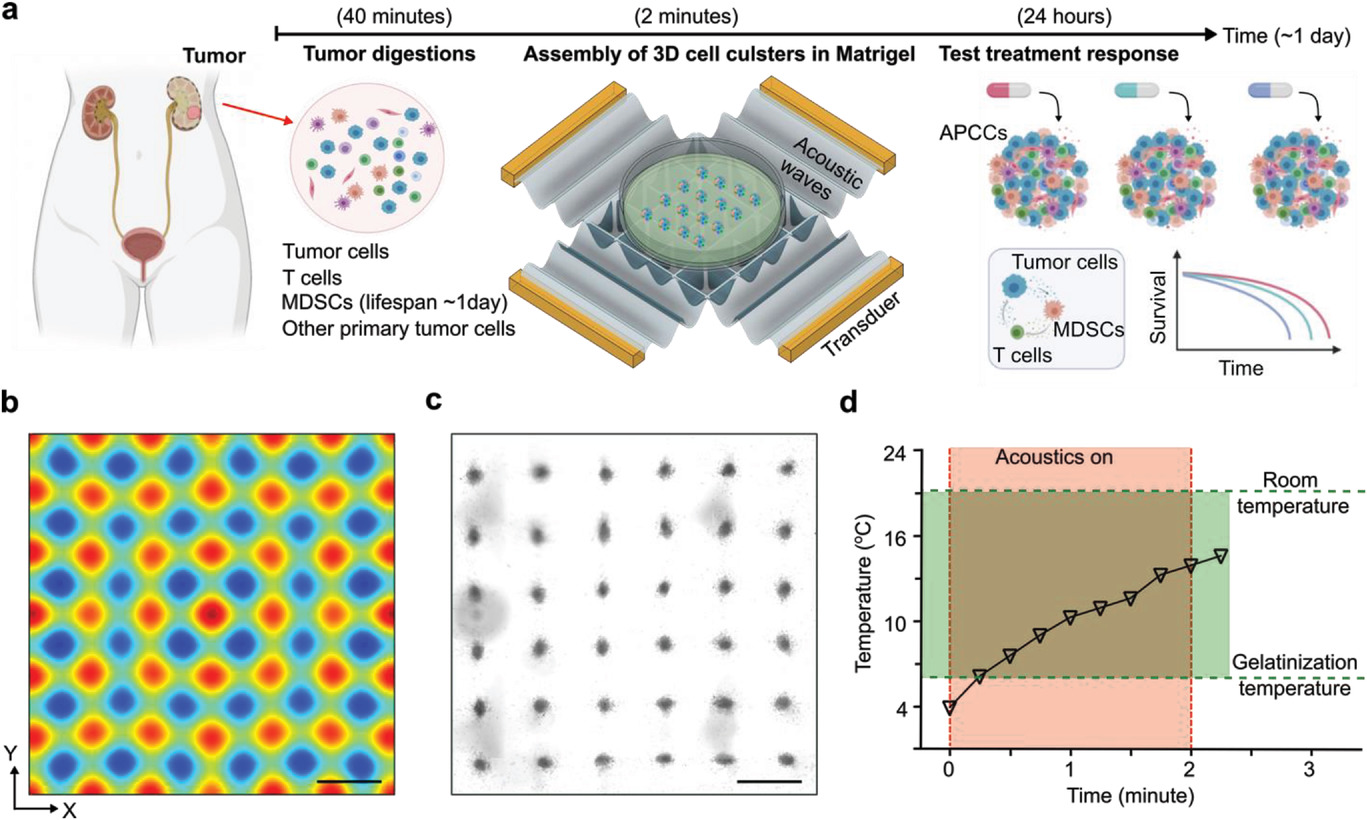
- (a)在Matrigel内生成3D APCCs的工作流程,使用声学细胞组装来模拟MDSC/T细胞/肿瘤细胞相互作用和测试治疗反应。该声学单元组装装置由两对压电换能器(PZT)和一个塑料支架组成。
- (b)模拟来自肾癌患者的肿瘤细胞快速组装的声场分布。
- (c)4°C下,2 min的声学组装和Matrigel凝胶化后,Matrigel内的大量3D细胞簇的图像。
- (d)在室温下进行2 min声学处理和热交换期间的温度动态。
APCCs Preserve the Viability and Phenotypes of MDSCs
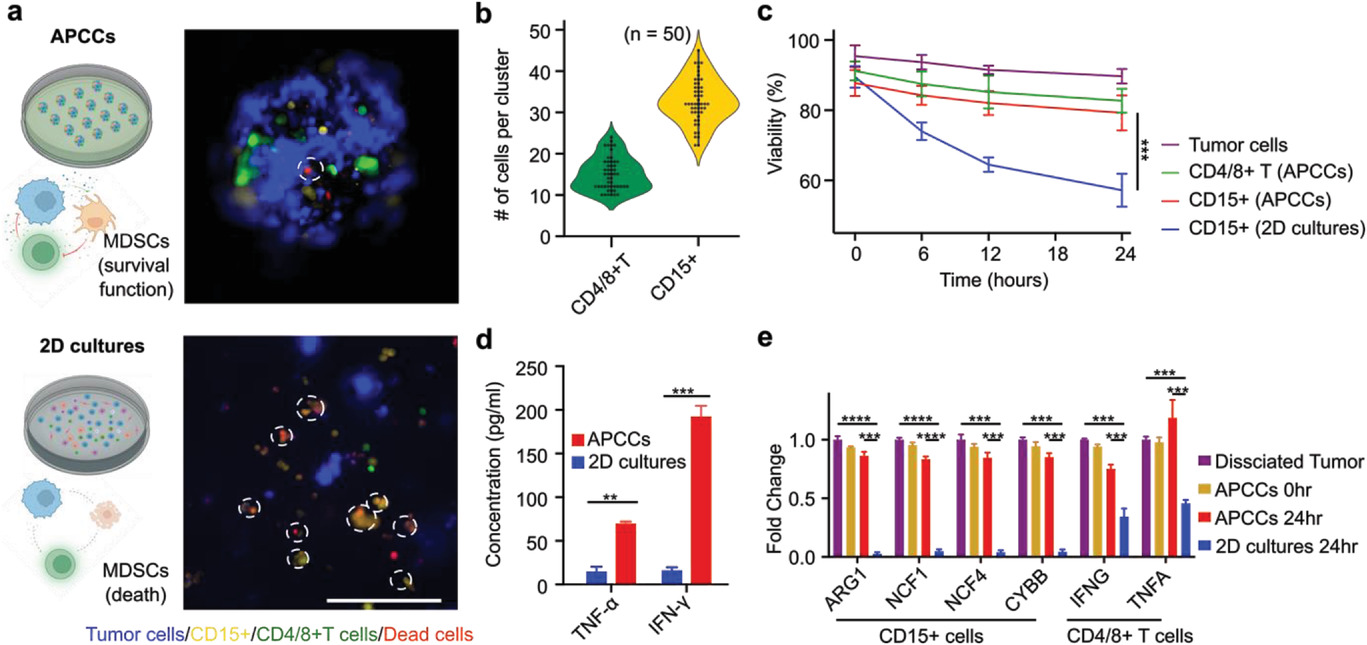
- (a)APCCs和2D培养条件之间的CD15pos细胞活力比较。通过DiL celltracker染料(黄色)鉴定CD15pos细胞。通过细胞死亡指示剂(红色)和预标记的CD15poscells(虚线圆圈)的重叠来识别CD15poscells死亡。其中MDSCs(CD15pos细胞)、T细胞(CD4pos细胞/CD8pos细胞)均事先用磁珠分离并分别活染。
- (b)每个APCC簇内CD15pos细胞和CD4/8pos T细胞的计数,发现它们呈相对均匀的分布。
- (c)量化肿瘤细胞、CD15pos细胞和CD4/8pos T细胞在APCCs内的活力,并与2D培养条件进行比较,CD15pos细胞在APCCs中活性显著高于2D培养条件。
- (d)ELISA分析来自2D和APCCs培养物,与2D培养物相比,APCCs的上清液中IFN-γ增加了12倍,TNF-α浓度增加了4.8倍,证明了其更好地保护局部细胞因子微环境的能力。
- (e)声学组装后0 h和24 h时,2D/APCCs条件下CD15pos细胞和 CD4/8pos T 细胞的基因表达分析。分析了介导一氧化氮(NO)和精氨酸酶-1(ARG-1)产生的关键基因(ARG1、NCF1、NCF4、CYBB)的表达,作者发现,虽然在2D培养中,ARG1、NCF1、NCF4和CYBB表达在CD15pos细胞中迅速丢失,这可能是由于缺乏细胞-细胞接触;但这些基因特征并未被声学组装改变,并且在APCCs的24 h培养期中很大程度上保留。同样,与2D培养条件相比,APCCs也更好地保留了T细胞的TNFA和IFNG表达。
APCCs Model MDSC-Mediated Tumor Immunosuppression

- (a)具有所有肿瘤成分(对照)、CD15pos细胞去除和CD15pos细胞+CD4/8pos T细胞共去除条件的声学组装的患者衍生细胞簇(APCCs)的延时图像。
- (b)APCCs内的肿瘤细胞死亡量化。MDSCs在肿瘤中的主要功能之一是它们抑制T细胞介导的肿瘤细胞杀伤。为了研究此功能是否保留在APCCs中,作者着手研究去除MDSCs对APCCs内细胞相互作用的影响。通过磁珠预先从分离的肿瘤细胞中去除了CD15pos细胞(包括PMN-MDSCs)。通过对照和去除CD15pos细胞的APCCs内的延时成像观察到肿瘤细胞死亡。作者发现,在去除CD15pos细胞后,APCCs内的肿瘤细胞死亡在24 h增加了43.4 ± 10.8%。为了进一步证实这种增强的肿瘤细胞死亡是T细胞依赖性的,将CD4/8pos T细胞与CD15pos细胞一起耗尽,发现肿瘤细胞死亡显著降低到甚至低于对照条件的水平。
- (c)来自对照、CD15pos细胞去除和CD15pos细胞+CD4/8pos T细胞共去除条件的培养中上清液中TNF-α和IFN-γ浓度的ELISA分析。发现CD15pos细胞的去除确实增强了APCCs内的TNF-α和IFN-γ细胞因子水平,作为潜在增强的T细胞活化的指标。此外,这种增加的细胞因子分泌也在T细胞共去除后被消除。因此,作者证实了APCCs内的CD15pos细胞部分保留了MDSCs功能以抑制T细胞。
APCCs Test MDSC-Targeting and Combinational Treatments
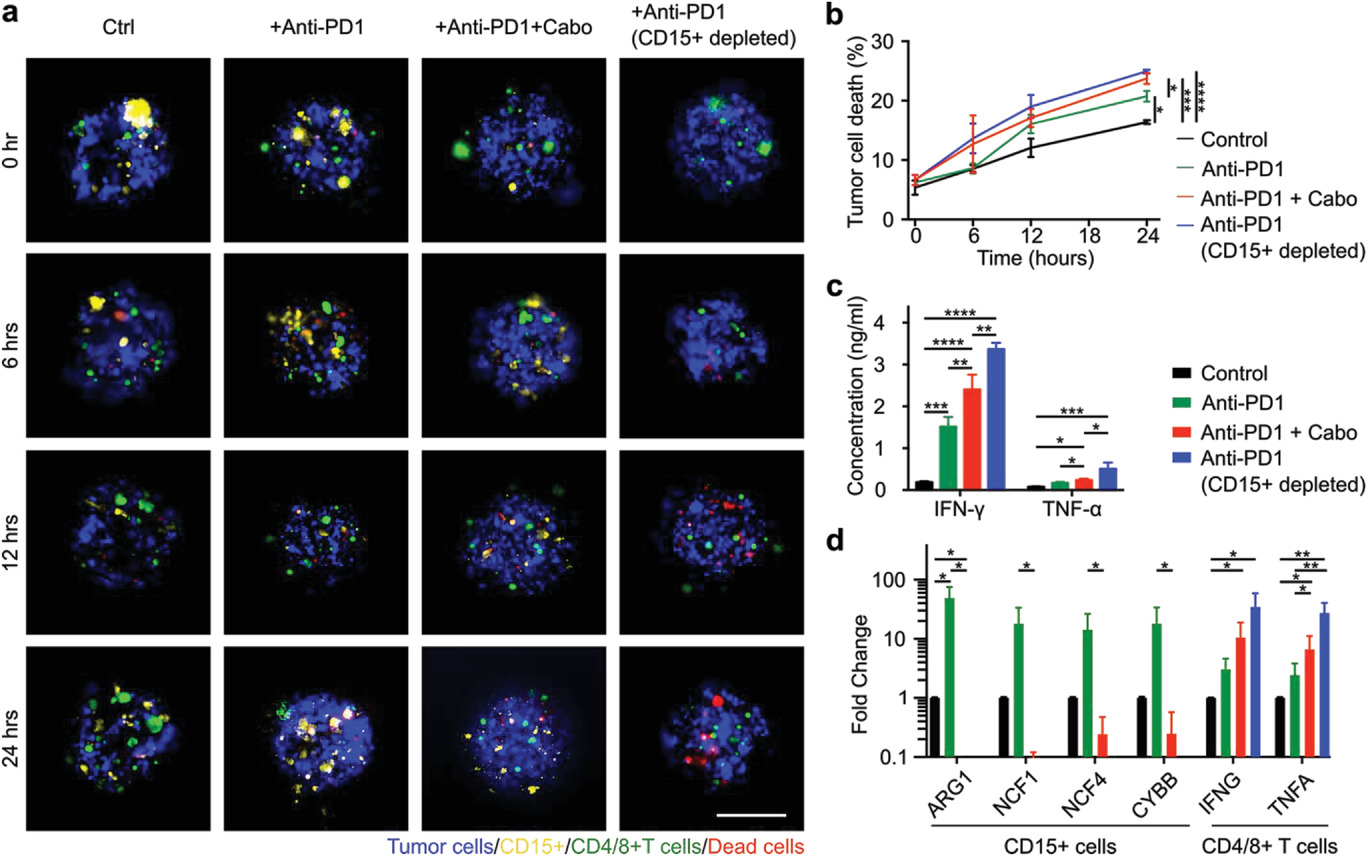
- (a)声学组装的患者衍生细胞簇(APCCs)与对照、抗PD1、抗PD1与卡博替尼组合以及CD15pos细胞去除条件下的抗PD1治疗的延时图像。
- (b)APCCs内的肿瘤细胞死亡量化。MDSCs介导的免疫逃避是肿瘤发展的关键机制,因此,作者试图验证APCCs作为潜在模型来研究MDSCs靶向药物单独或与ICI组合的治疗效果。作者观察到与未处理的对照相比,单独的抗PD1治疗可以使RCC衍生的APCCs内的肿瘤细胞死亡增加17.0 ± 9.4%。当抗PD1和卡博替尼联合治疗时,与未治疗的对照组相比,APCCs内的肿瘤细胞死亡增加了33.7 ± 6.5%。与单独使用抗PD1治疗相比,药物诱导的肿瘤细胞死亡增加了123 ± 67%。此外作者还研究了抗PD1治疗对完全去除CD15pos细胞的APCCs的影响,与未处理的对照组相比,该组产生了更高的肿瘤细胞死亡,增加了40.9 ± 9.4%。
- (c)来自对照、抗PD1、抗PD1与卡博替尼组合以及CD15pos细胞去除条件下的抗PD1治疗的培养上清液中TNF-α和IFN-γ的ELISA分析。作者发现,仅抗PD1治疗组的TNF-α和IFN-γ水平均升高,联合治疗组和MDSCs去除组加抗PD1治疗组进一步升高。
- (d)来自对照、抗PD1、抗PD1与卡博替尼组合以及CD15pos细胞去除条件下的抗PD1治疗的T细胞的qRT-PCR分析。作者发现MDSCs抑制基因在抗PD1治疗组中略有上调,可能是对T细胞活性增强的反应。但这些抑制基因表达在抗PD1和卡博替尼联合治疗组中几乎完全消除,表明卡博替尼有效抑制了MDSCs的抑制功能。至于T细胞,与ELISA数据一致,TNFA和IFNG基因表达通过抗PD1治疗得到增强,通过与卡博替尼联合治疗进一步增强,并且在CD15pos细胞去除+抗PD1治疗组中最高。
Discussion
- 实体瘤和其他实体组织通常具有组织特异性环境,该环境重编程浸润的免疫细胞以诱导组织特异性表型,例如肿瘤诱导的 MDSCs。 一旦脱离其环境,这些组织驻留免疫细胞的原位表型通常会由于稀释的旁分泌细胞因子环境和缺乏细胞间相互作用而迅速丢失。在这项工作中,作者报告了声学组装的患者衍生细胞簇(APCCs),以快速、高通量和无标记的方式快速将细胞聚集成紧凑、均匀的簇,从而保留原始的肿瘤成分、局部细胞-细胞相互作用和旁分泌因子。
- 通过展示对微环境敏感、难以培养的TME生态位细胞类型:肿瘤诱导的MDSCs的活力和功能表型的保存,证明了其APCCs的优势。MDSCs是TME中一种关键的免疫抑制细胞类型,可介导对ICI治疗的抗性,在ICI耐药或难治性实体瘤中靶向MDSCs的兴趣越来越大。 此外,MDSCs还被证明在非肿瘤环境中发挥关键作用,例如急性细菌和病毒感染以及自身免疫性疾病 。
- 然而分离的sMDSC的传统二维培养会导致细胞快速死亡以及关键表型的丢失。作者证明,通过快速(2 min)、无标记的声学组装,APCCs不仅可以保持MDSCs的活力,还可以保持它们的表型,包括ARG-1和NO产生相关基因的表达。且这些APCCs内的MDSCs在体外也可以抑制T细胞介导的肿瘤细胞死亡。
- 患者来源的组织/细胞拥有重要的遗传、表观遗传、转录组和蛋白质组信息,这些信息对于患者的遗传学和他们接受的治疗是独一无二的。患者来源组织的分析显示出在疾病诊断、预后和精准医疗方面的巨大潜力。传统的分子谱分析技术,如 DNA/RNA 测序,将肿瘤视为大块组织,缺乏有关组织内特定细胞类型功能表型的信息。 CyTOF或单细胞测序等单细胞分析技术可以提供有关组织细胞亚群的信息。然而它们相当昂贵,不能用于直接研究药物治疗反应。
- 患者衍生异种移植(PDX)模型可用于个体化药物治疗研究。然而,PDX需要大量组织,不适合高通量筛选研究,也不能用于研究原始组织内的免疫成分。APCCs提供了一种替代解决方案,可以在声学组装的3D培养物中保留原始组织构成,并在24 h内读取数据,快速分析药物治疗反应。
- 总体而言,该方法提供了一种新工具,用于快速研究局部细胞-细胞相互作用,从而保留细胞表型及其对治疗的反应。目前的APCCs的一个限制是它们缺乏TME其他方面的代表性,例如肿瘤脉管系统、与外周免疫系统的相互作用以及对治疗反应的动态进化。也缺乏对肿瘤转移的相关研究。
Reference
Ao Z, Wu Z, Cai H, et al. Rapid Profiling of Tumor-Immune Interaction Using Acoustically Assembled Patient-Derived Cell Clusters[J]. Advanced Science, 2022, 9(22): 2201478.



