
一种自动化高通量微流控平台,能够对免疫细胞浸润动力学和靶癌细胞杀伤实时成像。
Introduction
思路:
- 有效的免疫系统对抗癌十分重要,然而免疫逃避是癌症的关键特征之一。在肿瘤发展过程中,淋巴细胞渗入肿瘤并抑制其发展。与此同时肿瘤通过下调抗原表达,分泌细胞外基质(ECM)来物理限制淋巴细胞的浸润,以及分泌化学因子/细胞因子来排斥淋巴细胞,从而逃避这种免疫监视。
- 肿瘤浸润淋巴细胞(TILs)的高密度与许多癌症类型的预后改善相关。除TIL密度外,临床证据显示,实体瘤内TILs的类型、浸润深度、聚集指数和激活状态与疾病进展和治疗效果密切相关。消除T细胞介导的抗肿瘤免疫“刹车”的免疫检查点抑制剂(ICI)对实体瘤治疗具有潜在更好结果。然而,癌症患者对包含ICI药物的治疗方案的反应差异很大,实体瘤的总体反应率从<10%到40%不等。ICI治疗的无效性主要可归因于有限的TIL浸润。然而,TIL浸润行为在癌症免疫治疗发现中还没有被彻底研究和利用。因此,基于TIL行为的方法可能成为发现有效的免疫疗法和/或联合疗法的重要工具,这些疗法不仅能提高T细胞的细胞毒性,还能同时促进T细胞的肿瘤浸润。
到目前为止,研究癌症免疫疗法主要是利用体外二维(2D)细胞培养和/或体内动物模型进行的。然而,这些模型有一些明显的局限性:
- 2D培养物不能再现肿瘤的关键生理特征,如肿瘤的基质物理屏障和缺氧核心;
- 动物模型因其可扩展性而受到限制,且耗时耗力。
基于2D培养的筛选方法往往依赖于容易获得的读数,如T细胞的细胞毒性、激活状态和细胞因子谱,而忽略了T细胞肿瘤浸润行为的更复杂的动态变化。相比之下,三维(3D)肿瘤培养物,如类器官/细胞球,可以被构建为包括体内肿瘤的关键生理方面如肿瘤基因型和表型、细胞-细胞接触、ECM屏障和缺氧核心,从而受益于其阐明动态免疫细胞-肿瘤相互作用的潜力。然而,3D肿瘤培养的挑战,如难以产生可扩展的、统一尺寸的和标准化的类器官/细胞球,以及厚的ECM包埋阻碍了自由免疫细胞的浸润和交互作用,限制了高通量T细胞行为表型筛选。此外,手动获取和分析从3D培养物中产生的大量数据,对建立高效和可扩展的高通量筛选构成了障碍。最近,基于深度学习方法的自动化数据分析方法提高了分析病理切片中TIL评分的一致性和准确性。尽管深度学习方法很有前景,但还没有被用于体外模型的TIL模式分析。因此,开发高通量、标准化和自动化的技术,结合深度学习进行自动TIL行为分析,将为免疫疗法筛选的进一步进展铺平道路。
- 在此,作者报告了一个基于T细胞行为(如肿瘤浸润)的免疫疗法发现的高通量、自动化系统,可以同时研究T细胞浸润行为和细胞毒性。
Integration of Automated Screening System
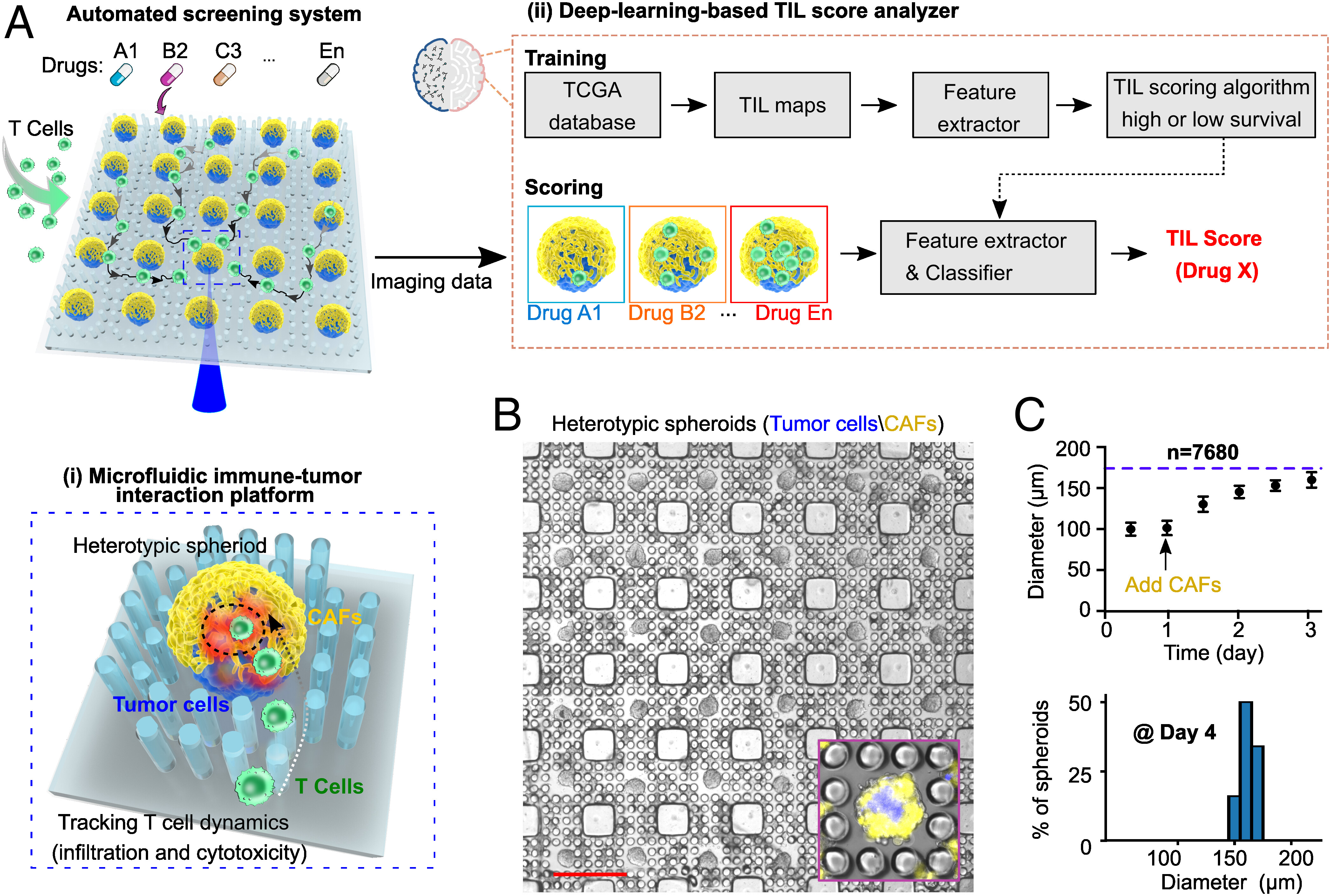
(A)用于癌症免疫疗法筛选的自动筛选平台示意图,包括:
- (i)用于高通量追踪T细胞动态行为的微流控免疫-肿瘤互动平台。通过在孔板中引入柱阵列,可以产生7680个大小一致的异型肿瘤球。每个肿瘤球由统一的肿瘤核心和外层基质组成,代表了原发性肿瘤的基本特征,其核心大小和外层厚度都可调整。该平台可以在不同的治疗条件下对大量肿瘤球内的免疫细胞动态行为进行灌注、相互作用和延时跟踪,减轻了长期共培养和成像的技术不一致性,如肿瘤球的融合、大小变化和运动。
- (ii)基于深度学习的TIL评分分析器,用于图像处理和T细胞浸润模式的评分,这些模式与高生存率(>3 years)或低生存率患者组的图像中的TIL模式相对应。为了处理微流控平台的大量T细胞行为数据,作者纳入了自动图像采集和基于图像的筛选。深度学习的TIL评分算法是利用临床数据进行训练的,包括数字病理图像和来自The Cancer Genome Atlas(TCGA)数据库中397名黑色素瘤患者的411个肿瘤的生存数据,然后作者的TIL评分分析器自动生成T细胞浸润分数,这些分数分别对应于从高生存率(>3 years)或低生存率患者组的图像中学到的TIL分布模式。微流控平台与基于深度学习的TIL评分分析器整合在一起,产生了一个自动筛选系统,以确定免疫细胞的行为,并以高通量和自动化的方式实现免疫治疗药物的筛选。
(B)核心/肿瘤-外壳/基质球的可扩展的微流控制造(肿瘤核心:蓝色;CAF,外壳:黄色)。
- (C)肿瘤球在柱阵列中的生长(箭头表示肿瘤核心形成后CAFs的接种),以及在肿瘤球形成的第4 d,肿瘤-基质球的大小分布。
Formation of Scalable Tumor-Stroma Spheroid Array
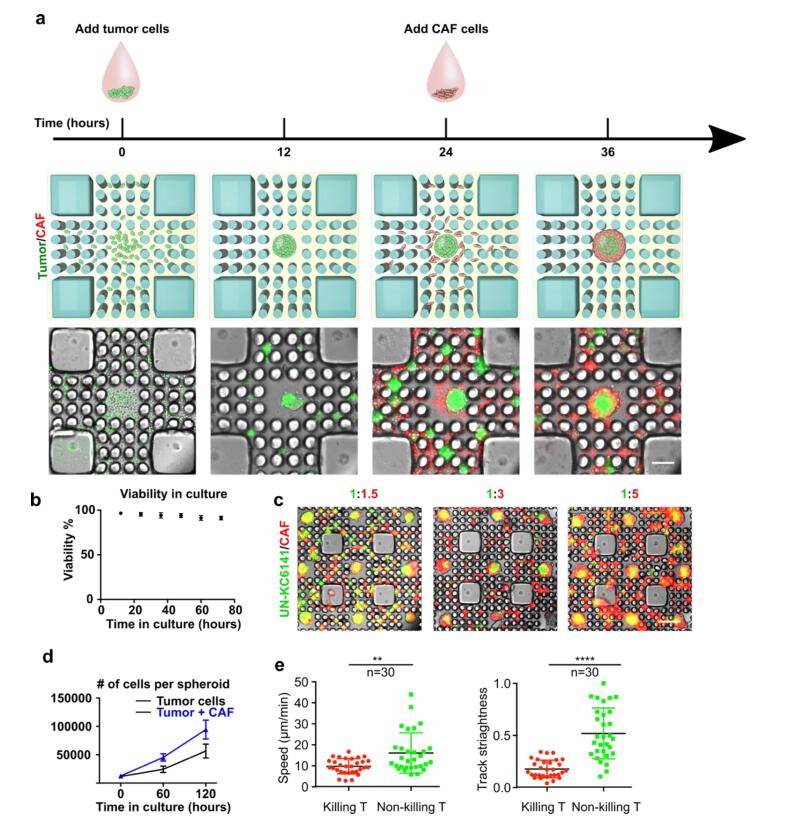
- (A)通过依次加入肿瘤和CAF细胞形成“核心/肿瘤-外壳/基质”球。
- (B)肿瘤球在长期培养中的活性。
- (C)可调控的肿瘤/CAF比例导致“核心/肿瘤-外壳/基质”球的基质厚度变化。
- (D)每个肿瘤球初始接种约9000个细胞,不同比例(纯UNKC6141细胞或UNKC6141细胞:CAF细胞=3000:6000),导致肿瘤球生长不同。表明CAFs保留了它们在体内的功能,促进肿瘤细胞的增殖。
- (E)在杀伤性和非杀伤性T细胞中观察到不同的速度和轨迹直线度。
Tracking Dynamic T Cell Behavior within 3D Cultures
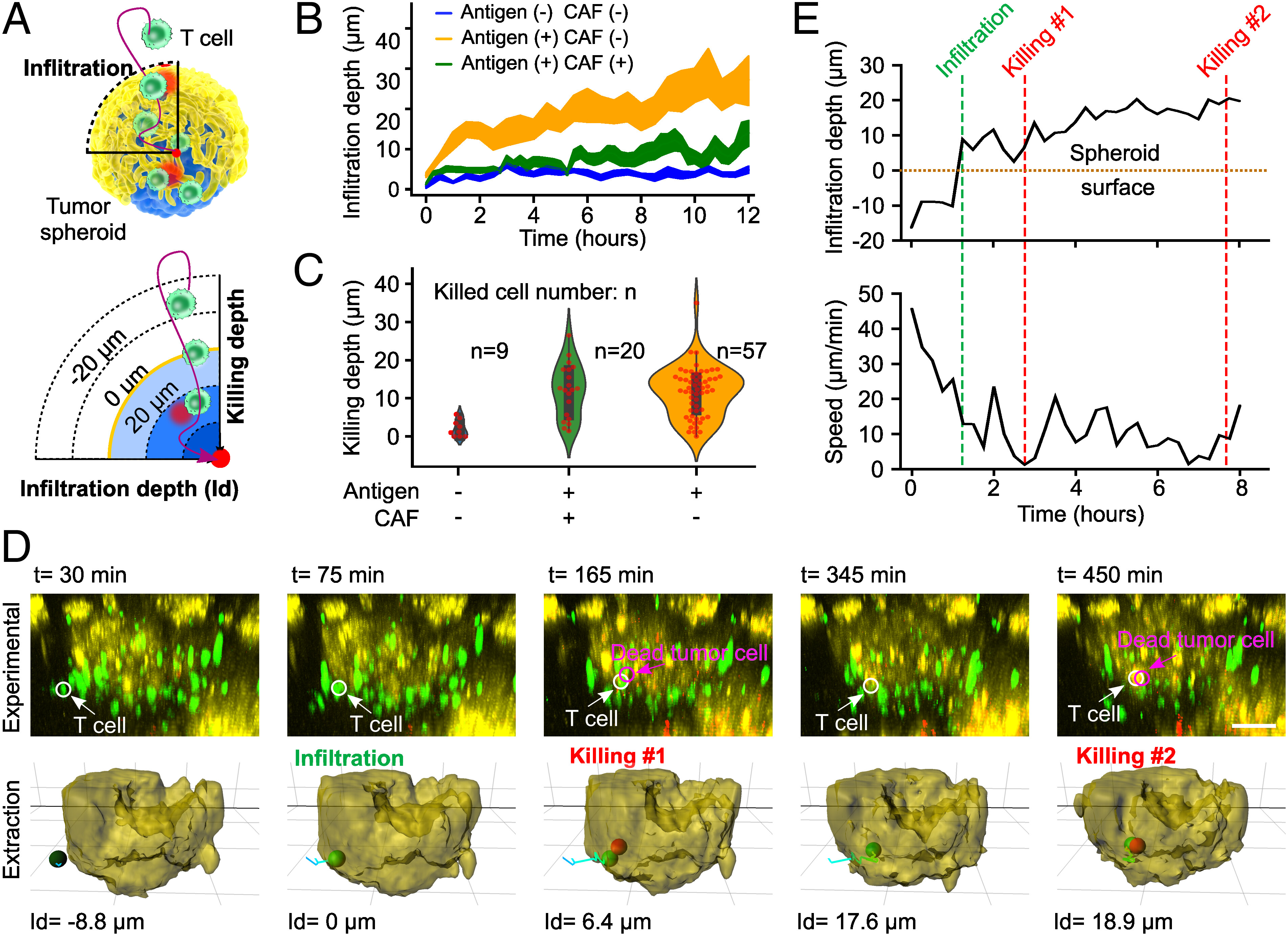
- (A)T细胞和肿瘤球之间的动态相互作用示意图。T细胞浸润深度被定义为细胞到球体表面的径向距离,一旦T细胞浸润到球体中(或在球体外),浸润(或杀伤)深度为正(或负)。为了可视化肿瘤抗原特异性T细胞与肿瘤的相互作用,作者将由卵白蛋白(OVA257-264)呈现的肿瘤细胞与CAFs外壳组成的肿瘤核心置于OVA抗原特异性T细胞(OT-I细胞)中。
- (B)T细胞浸润对肿瘤核心的抗原(抗原(+))和基质/CAF外壳(CAF(+))的依赖。
- (C)T细胞杀伤深度和能力(n:被杀细胞数)对肿瘤核心的抗原(抗原(+))和基质/CAF外壳(CAF(+))的依赖。
- (D)肿瘤球内单个T细胞的浸润和杀伤动态的延时图像及其提取。白色(或品红色)箭头和圆圈表示T细胞(或死亡的肿瘤细胞),浸润深度(Id)的负值表示肿瘤球外的T细胞,正值表示肿瘤球内的T细胞。可以观察到,一个T细胞以高速冲向肿瘤球,以较慢的速度渗入球体,对一个肿瘤细胞进行杀伤,然后继续以较高的速度移动,寻找下一个目标肿瘤细胞。
- (E)同一T细胞(在D中)的浸润深度和速度随时间变化的量化。绿色和红色的虚线表示该T细胞的浸润和杀伤事件。
Training the Deep Learning–Based TIL Score Analyzer Using a Clinical Database
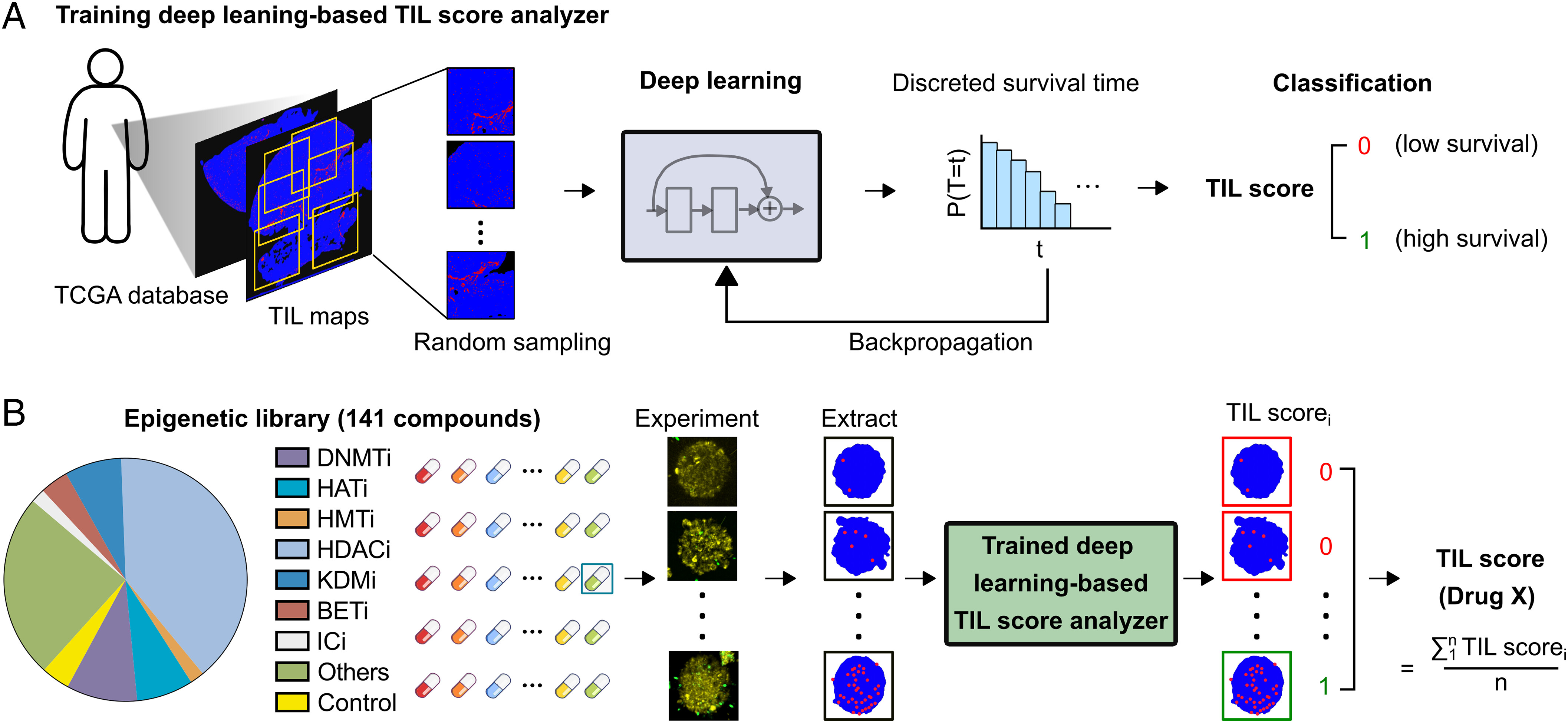
- (A) 使用TCGA数据库中411个病人的肿瘤H&E图像和相关的病人生存信息训练基于深度学习的TIL评分分析器的示意图。
- (B)示意图显示了141个小分子表观遗传调节剂库的筛选情况。作者的自动系统跟踪每种药物的T细胞肿瘤浸润图像,提取T细胞图谱,为每个图像分配TIL scorei(如0,1),并通过对药物治疗图像的多个TIL scorei进行平均,生成药物X的最终TIL得分。
Screening of Epigenetic Drugs
表观遗传药物可以促进抗原呈递,逆转T细胞衰竭,或通过激活内源性逆转录病毒介导的途径增强炎症相关基因。作者选取了一个小分子库,其中的小分子可能具有细胞毒性活性(如抗增殖、直接杀伤)和/或免疫调节作用(如改变T细胞的细胞毒性、T细胞浸润)。由此可以进行:药物细胞毒性筛选和免疫治疗筛选。
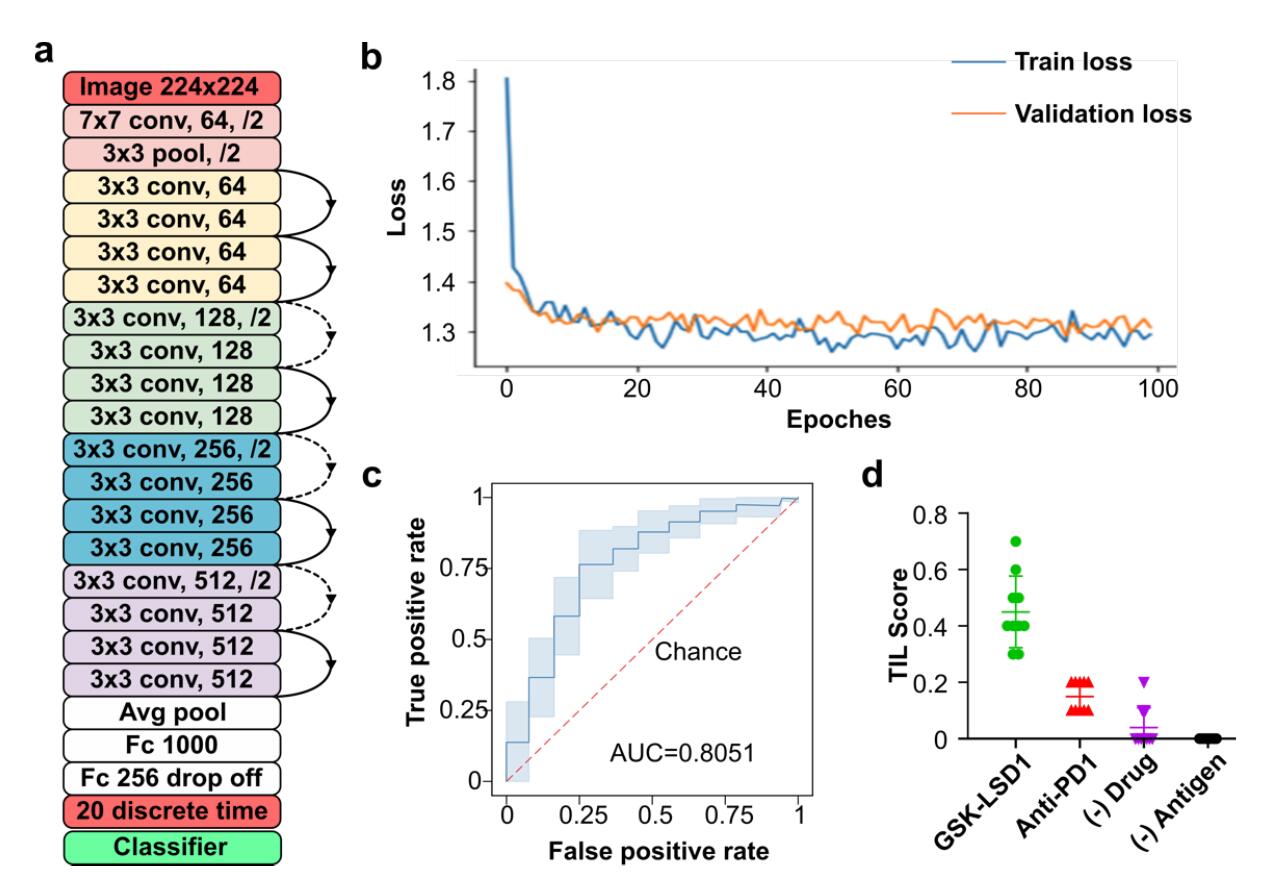
- (A)网络结构图示。
- (B)训练损失和验证损失的代表性训练曲线。
- (C)由分类器产生的交叉验证的时间依赖性ROC曲线,用于3年生存预测,AUC为0.8051。
- (D)不同药物的TIL评分预测。药物GSK-LSD1是一种LSD1的小分子抑制剂,其TIL得分达到0.6,呼应了以前的研究,即使用LSD1基因敲除的动物模型,其中T细胞的招募和激活得到促进。
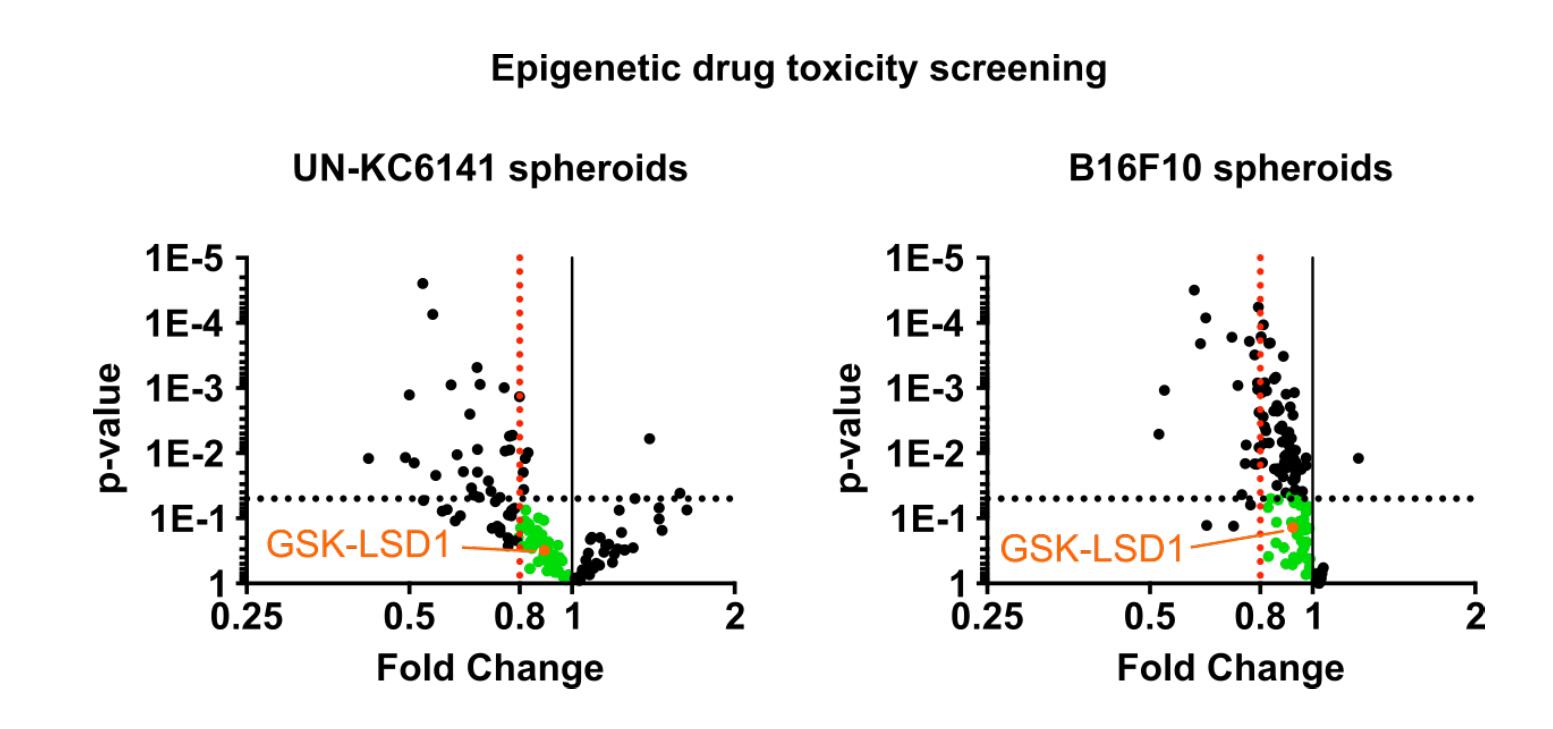
表观遗传药物的细胞毒性筛选。UN-KC6141肿瘤球和B16F10肿瘤球用5 μM的表观遗传药物处理24 h,用CCK-8试验测量细胞毒性。没有细胞毒性的药物(细胞存活率>80%,P值>0.05)被选择用于T细胞浸润筛选。
In Vitro Validation of the Top Drug Candidate and Development of Combination Therapy
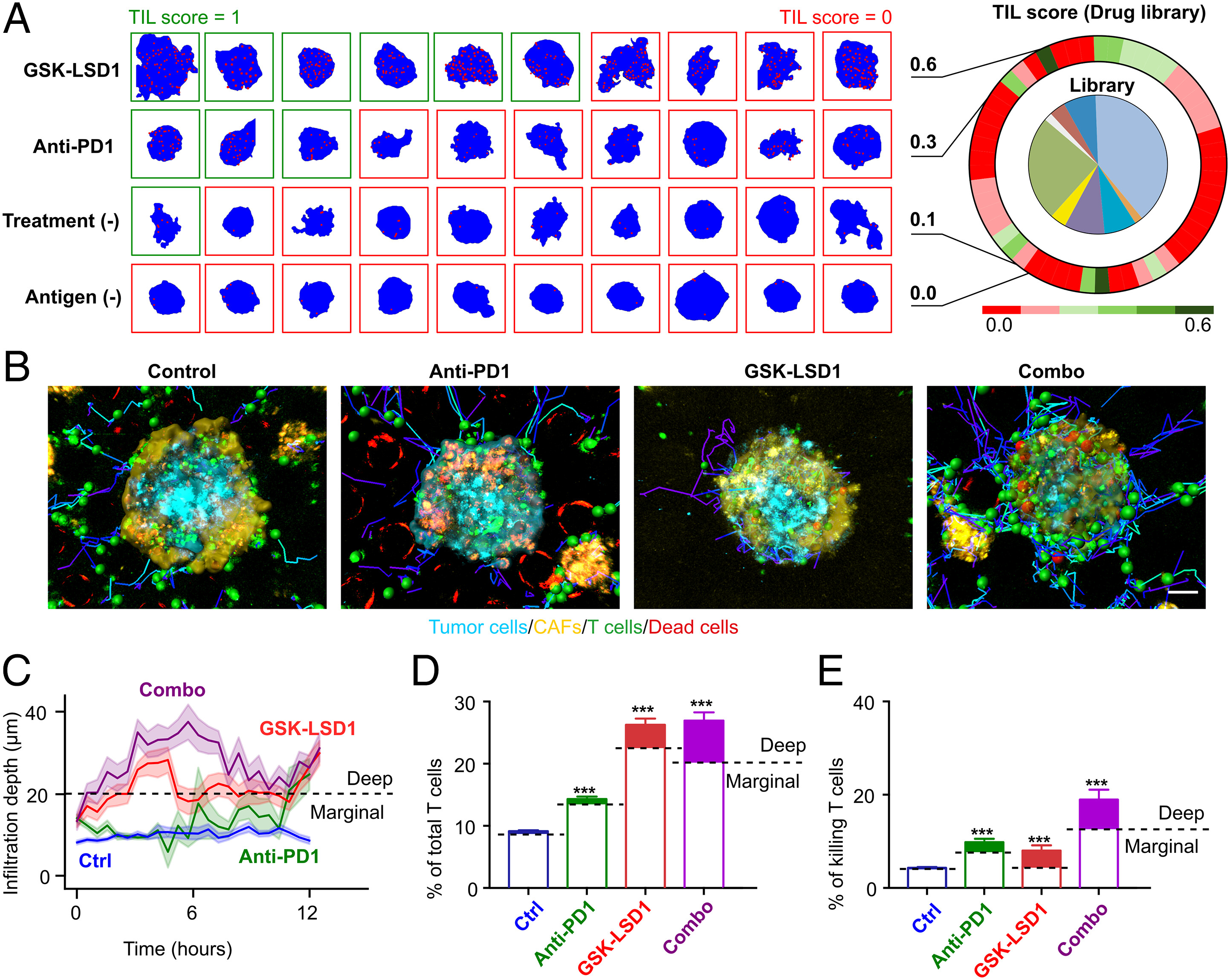
- (A)库的筛选结果。热图显示了对照条件和药物条件的TIL得分。不同药物处理下肿瘤球(蓝色背景)内的T细胞(红点)分布的代表图像。
- (B)从四种治疗条件(未处理的对照、抗PD1、GSK-LSD1和联合治疗)下异型肿瘤球体内T细胞浸润和细胞毒性的时间推移图像中提取细胞位置和轨迹。
- (C)在四种治疗条件下,T细胞浸润深度随时间变化。
- (D)浸润的T细胞占总T细胞的平均百分比。深入肿瘤球状体内的T细胞(浸润深度>20 μm)被认为是深层浸润的T细胞,用填充色说明。
- (E)平均杀伤性T细胞占总T细胞群的百分比。位于肿瘤球状体深处的杀伤事件用填充色标记。可见,联合治疗提供了最大的浸润深度、浸润T细胞数量和细胞毒性T细胞数量。GSK-LSD1治疗增强了T细胞浸润,并与抗PD1治疗相结合促进了深度浸润和细胞毒性。
In Vivo Validation of the Top Drug Candidates
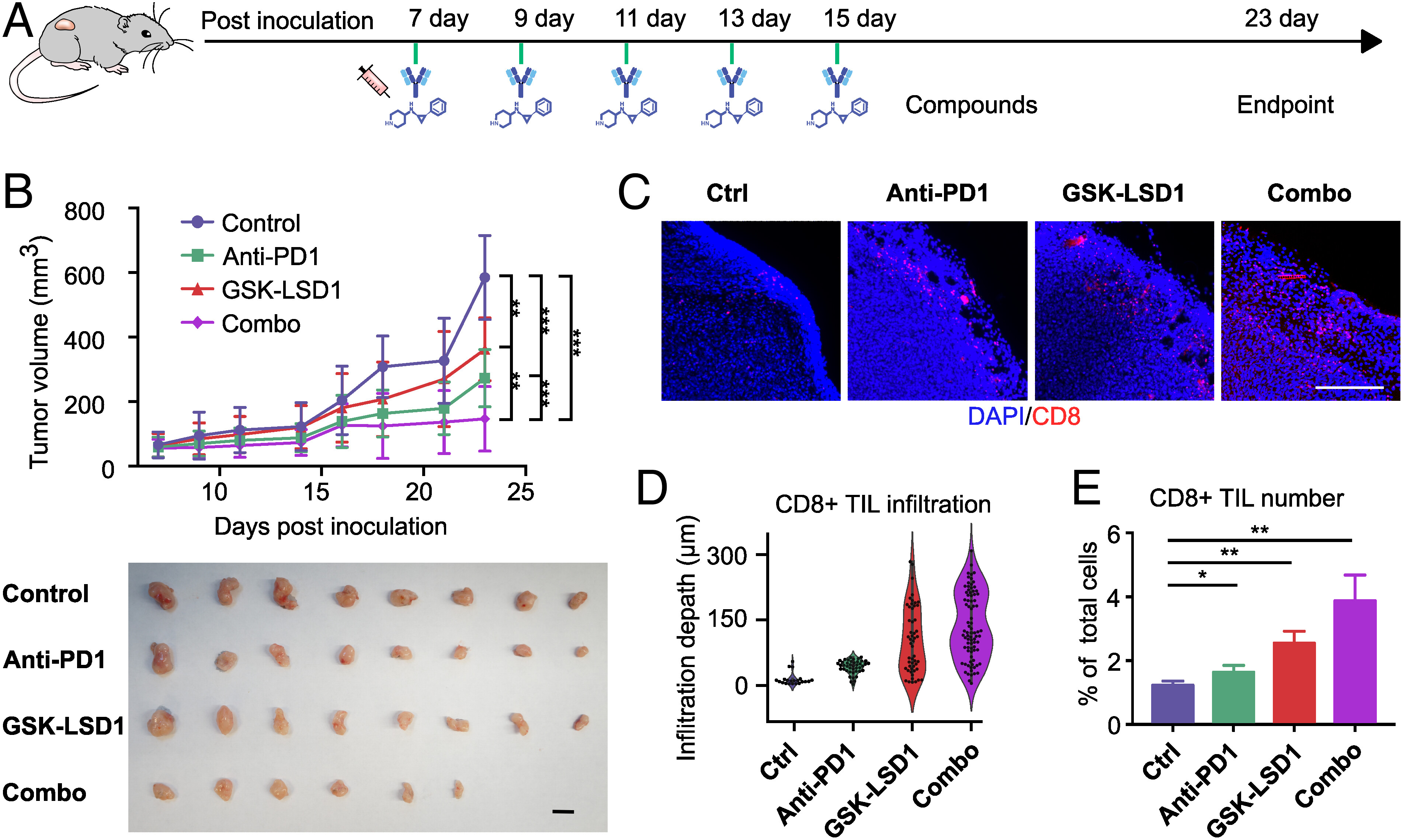
- (A) 肿瘤接种和治疗时间线。在第7、9、11、13和15 d腹腔内注射抗PD1和GSK-LSD1。所有的动物在第24 d被安乐死以收获肿瘤。
- (B)四个治疗组的肿瘤生长曲线和最终大小。
- (C)四个治疗组的肿瘤切片中浸润的CD8+T细胞的代表图像。在GSK-LSD1治疗组中观察到中度肿瘤生长抑制,当GSK-LSD1治疗与抗PD1治疗联合应用时,观察到更大的肿瘤生长抑制,八只小鼠中有两只的肿瘤完全消退。
- (D)肿瘤切片中的T细胞浸润深度分布。
- (E)流式细胞仪分析所有肿瘤细胞中CD8+T细胞的百分比。与对照或抗PD1处理小鼠的肿瘤相比,GSK-LSD1处理肿瘤的CD8+T细胞数量显著增加。
Discussion
- 实体组织中的免疫浸润和细胞毒性对于免疫监视、炎症、自身免疫性疾病和免疫治疗至关重要。然而,目前的体外模型和方法在很大程度上缺乏对三维组织内免疫细胞动态行为的高通量跟踪和分析。作者开发了一个自动筛选系统,生成可扩展的统一尺寸的“核心/肿瘤-外壳/基质”球阵列,实现了免疫细胞的自由灌注,并实现了对免疫细胞-组织相互作用动态的自动跟踪和分析。作为癌症免疫治疗药物筛选的概念验证应用,该系统被用来以高通量和自动化的方式筛选表观遗传调节剂库。作者发现并在体内验证了一种表观遗传药物(GSK-LSD1),它能有效地促进T细胞的肿瘤浸润,并与抗PD1治疗相结合增强T细胞的浸润和细胞毒作用。
- 与二维体外培养物相比,三维培养物可以再现原发性肿瘤的关键生理和病理方面,包括肿瘤结构、微环境和药物反应的敏感性。目前患者来源的三维培养物在细胞组成、细胞结构、细胞块的大小和形状方面存在着高度的异质性,限制了它们在高通量筛选和稳健测试方面的应用。因此,产生代表关键生理特征的可扩展的标准化三维培养物是至关重要的。
- 已经开发了基于二维培养的高通量筛选平台,该平台采用机器人自动处理培养细胞,并配有成像或读出系统进行分析。然而,跟踪三维培养物的药物反应或免疫相互作用的动态仍然存在挑战,部分原因是长期培养过程中发生的变化,如不均匀生长、随机融合、移动、旋转和坏死的核心。为了克服这些问题,作者将透明的PDMS柱状格子层集成到常用的孔板中,用于生成和固定大量均匀大小的肿瘤球。
- 病人肿瘤切片中的TIL浸润模式被证明可以预测病人的生存率。然而,目前对TIL浸润的评估主要依赖于视觉检查和有经验的病理学家的手工定性或定量分析。机器学习方法已被用于解决成像处理和从大量临床数据中提取TIL图的挑战,避免了源于人工解释的不一致和偏见。此外,TIL数量、浸润深度和集群等简单指标已被单独探索为预测患者生存或免疫治疗结果的指标,但尚未被统一为一个全面的单一“TIL评分”。在这里,利用TCGA数据库中的这种临床TIL图和生存数据,作者证明了一种机器学习方法产生了一个综合的TIL评分,该评分基于TIL图的特征模式与患者的生存时间有更好的相关性。
- 开发了一个自动筛选系统的原型,并展示了一个概念验证应用,用于筛选治疗实体瘤的免疫治疗化合物,其依据是通过深度学习识别的T细胞肿瘤浸润的特征。
Reference
Ao Z, Cai H, Wu Z, et al. Microfluidics guided by deep learning for cancer immunotherapy screening[J]. Proceedings of the National Academy of Sciences, 2022, 119(46): e2214569119.



