
一种在预先形成的肿瘤球中加入成纤维细胞来形成肿瘤球的策略。
Introduction
思路:
- 肿瘤血管是肿瘤微环境的一个关键组成部分,能将营养物质、氧气、治疗药物和免疫细胞输送到肿瘤部位。
- 现已有很多血管化肿瘤模型。肿瘤球有其独特的特点,它具有更高的细胞群复杂性,可以单独形成肿瘤细胞或与其他细胞类型(如成纤维细胞(FBs),内皮细胞(ECs)和周细胞)相结合。与组织细胞相比,肿瘤球模型更容易产生,而且可以更好地控制。
- 以前的研究表明,FBs在体外的肿瘤血管化中发挥了有益的作用,即有可能诱导血管向肿瘤方向生长。虽然已经证明FB在体外有利于肿瘤血管的形成,但目前还不清楚FB在肿瘤球的位置是否会进一步影响肿瘤血管的形成。
- 嵌合抗原受体(CAR)-T细胞疗法是治疗癌症的有力工具,尤其是对血液病的治疗。然而,许多挑战如适度的抗肿瘤活性、有限的肿瘤浸润和受限的运送,仍然限制了CAR-T细胞在实体瘤和血液恶性肿瘤中的疗效。 CAR-T细胞在不同患者身上的反应也不同,因为癌症患者有独特的病理特征,包括基因表达谱、肿瘤微环境组成、治疗史等。
- 为了克服这些挑战,有必要采用新的策略来设计、筛选和鉴定更强大的CAR-T细胞,以提高抗肿瘤活性和降低毒性,实现个性化医疗。作为临床前的一个步骤,通过使用人类细胞、添加各种其他类型的细胞、包括化学和物理特征,在再现肿瘤微环境的肿瘤模型中评估CAR-T细胞反应,可以减少临床失败的风险。然而,目前还没有用于CAR-T细胞反应评估的血管化肿瘤模型。
- 在这项研究中,作者介绍了一种新的策略,通过将FBs最初与肿瘤细胞混合(共混)或在肿瘤球体形成后(顺序)相结合来产生肿瘤球。共混球体中的FB均匀分布或富集在中心,而在顺序性肿瘤中它们往往位于外围。通过比较单独使用肿瘤细胞、与FBs共混的肿瘤细胞以及顺序策略所制成的肿瘤球状体的血管化水平,发现顺序肿瘤球状体的血管化水平最高。重要的是,顺序策略产生的肿瘤区域的更多血管是可灌注的。最后通过添加一个微型泵,使CAR-T细胞在血管化的肿瘤球中循环,并评估连续流动下的反应,来证明这种方法的优势。
Three Methods to Generate Tumor Spheroids for Vascularized Tumor-on-a-Chip Models
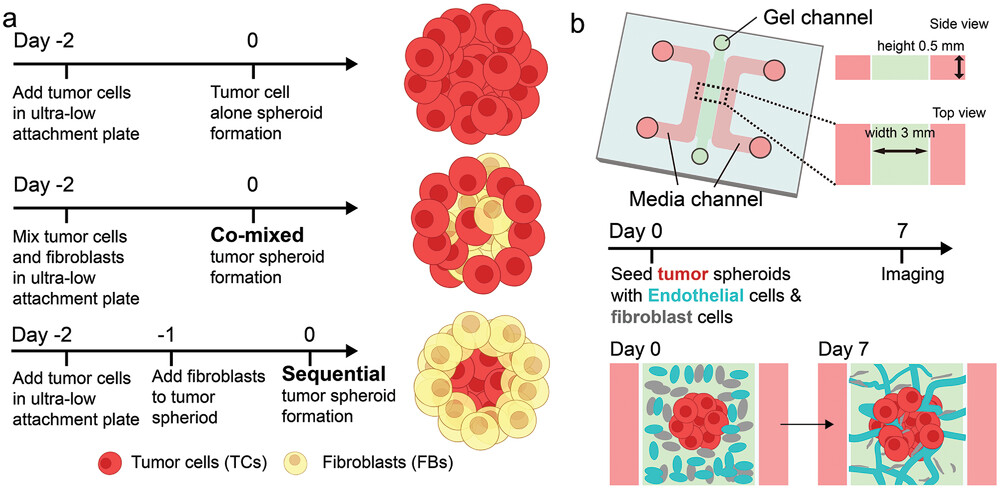
- (a)形成单独的肿瘤球、共混的肿瘤球和顺序肿瘤球的实验流程。
- (b)构建血管化肿瘤球的微流控装置示意图。
Sequential Tumor Spheroids Show Superior Vascularization

- (a)由单独、共混或顺序方法形成的SN12C肾癌细胞系肿瘤球的示意图、三维投影图像和切片图像。当SN12C细胞与FBs共混时,大部分FBs位于肿瘤球的中心,而SN12C则在外围区域,这与以前使用不同类型肿瘤的研究相似。相反,在顺序接种肿瘤球中,FBs在外围区域。
- (b)由单独、共混或顺序方法形成的血管化肿瘤球的三维投影图像。单独和共混的肿瘤球组都导致血管被排除在肿瘤区域之外。
- (c)肿瘤区域和附近50 μm距离区域的示意图,用于血管化分析。
- (d-e)肿瘤区域(d)或肿瘤 + 50 μm区域(e)的血管百分比统计分析。与其他方法相比,用顺序法形成的肿瘤球显示出最高的血管化水平。
- (f)肿瘤球的FB面积分析。与其他方法相比,用顺序法形成的肿瘤球相关的FBs面积最大,表明微环境重塑强烈,可能吸引更多的ECs来增加血管化,从而更好地模拟体内的血管化肿瘤。
Perfusion is Better in Vascularized Sequential Tumor Spheroids than Co-mixed Tumor Spheroids
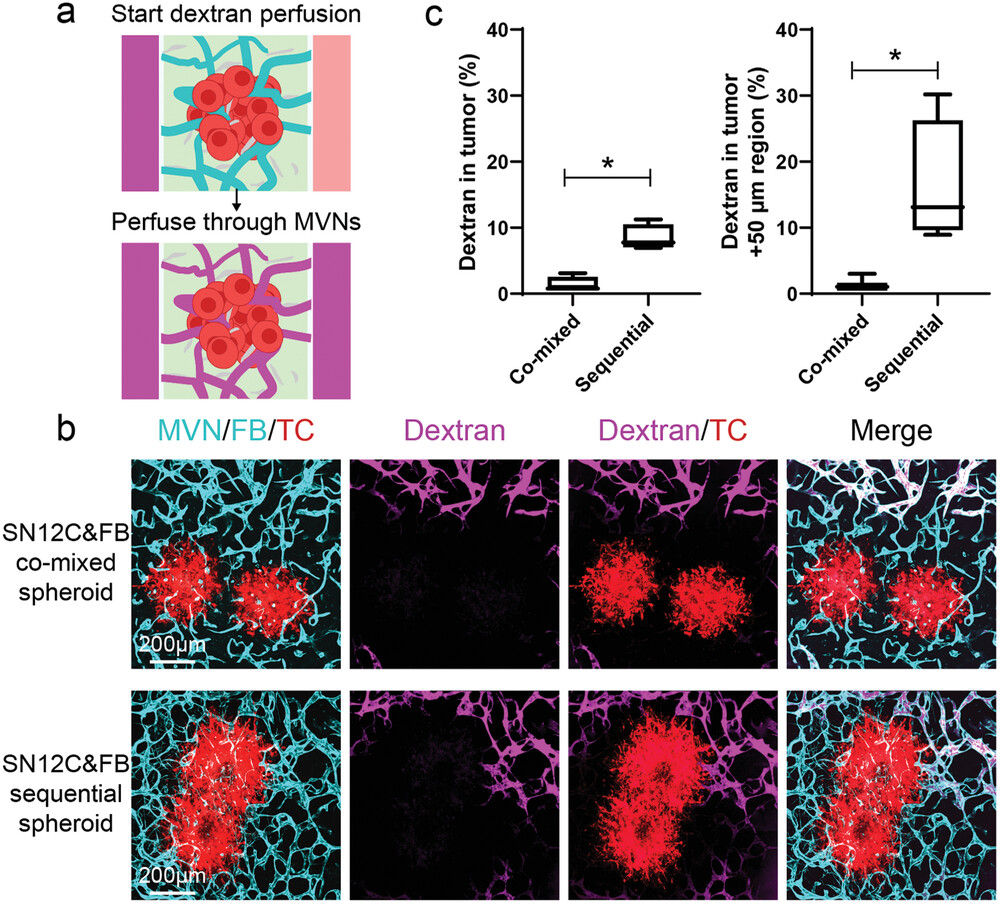
- (a)葡聚糖在肿瘤血管中的灌注示意图。
- (b)第7 d用荧光素葡聚糖(10 kDa)灌注的血管化SN12C共混或顺序肿瘤球的代表性共聚焦图像。装置在灌注葡聚糖后5 min内成像。 在共混球和顺序球的MVNs远端区域都检测到了葡聚糖,表明远离肿瘤球的MVNs的可灌注性很高。
- (c)肿瘤区域和肿瘤 + 50 μm区域的葡聚糖百分比的统计分析。靠近肿瘤球的可灌注的血管只在顺序肿瘤球组中发现。这表明在肿瘤球外围的FB的空间排列,促进了更多的血管靠近肿瘤球以及对血管的可灌注性有深刻的影响。
Sequentially-Formed Vascularized Tumor Spheroids Recruit more T Cells under Continuous Flow
有研究表明,间皮素(mesothelin)CAR-T细胞对卵巢癌细胞系Skov3有反应。因此在Skov3血管化肿瘤芯片模型中测试了间皮素CAR-T细胞。
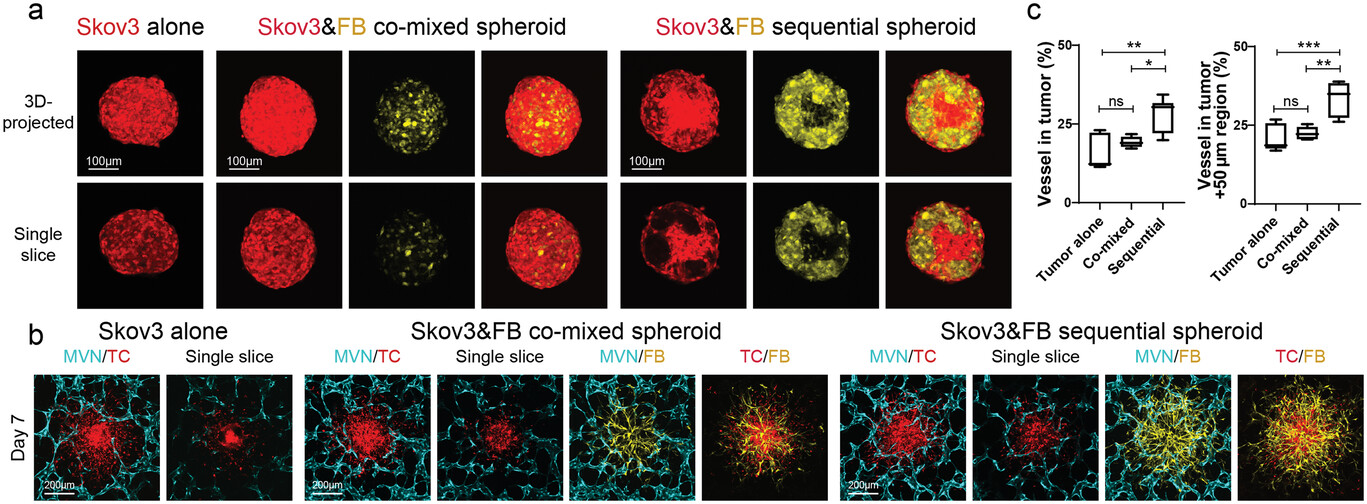
- (a)三种不同方法形成的Skov3卵巢癌细胞系肿瘤球的代表性共聚焦图像。
- (b)第7 d的血管化Skov3肿瘤球的代表性共聚焦图像。
- (c)肿瘤区域(左)和肿瘤 + 50 μm区域(右)的血管百分比的统计分析。用顺序法生成的Skov3肿瘤球显示出最高的血管化水平。
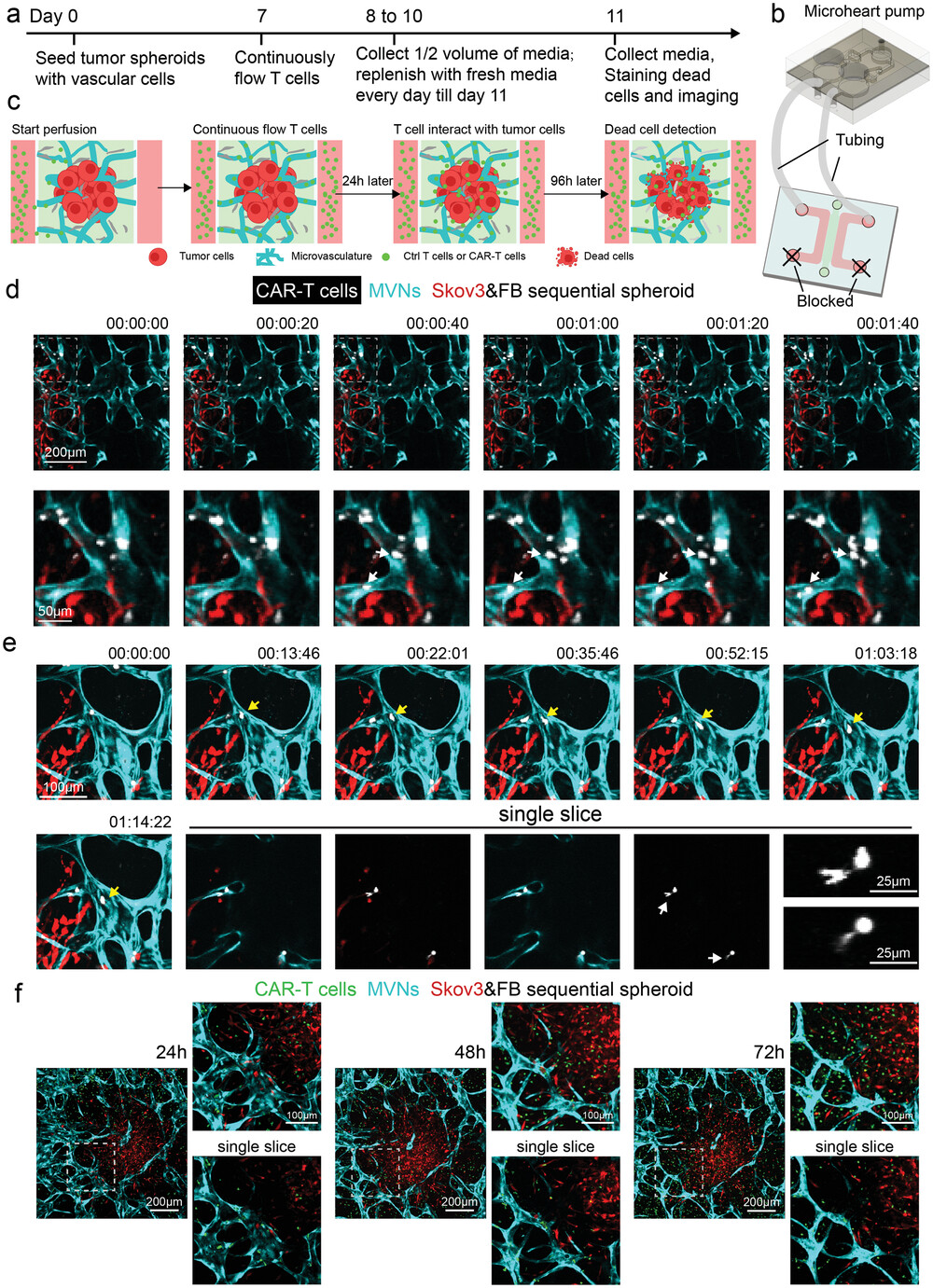
- (a)血管化肿瘤球模型中T细胞连续流动的实验过程。对照组T细胞或CAR-T细胞在第7 d灌注,再循环4 d。每24 h收集半体积的培养基,并补充到设备中。第11天,用核蓝DCS1(Nuclear Blue DCS1)对设备进行染色,以显示死细胞。
- (b-c)血管化肿瘤球模型中连续流动T细胞的简图。每个培养基通道的一个通道口通过管道连接到微心泵,而另外两个通道口被封锁,以形成一个闭环和连续流动。
- (d)CAR-T细胞流向MVNs的延时图像。大部分CAR-T细胞快速通过MVNs,一些细胞粘附在靠近肿瘤区域的血管顶端表面。白色箭头所指的是成像期间新附着的T细胞。
- (e)CAR-T细胞迁移和外渗的时间推移图像。黄色箭头标识出在血管中巡逻的T细胞。单片图像突出显示了正在进行外渗的T细胞。白色箭头标识出细胞外渗的部分。提供了这两个T细胞的放大图像。
- (f)血管化顺序肿瘤球组在24、48和72 h时间点的CAR-T细胞反应的代表图像。

- (a)用共混或顺序方法形成的血管化肿瘤球中T细胞和死细胞的代表性三维投影共聚焦图像。
- (b-c)对每105 µm2肿瘤区域的T细胞(b)或死细胞(c)数量进行统计分析。顺序肿瘤球组招募了更多T细胞,可能是由于血管化的增加;且灌注96 h后,在共混和顺序肿瘤球中,CAR-T细胞组的T细胞和死细胞密度都高于对照T细胞组。
- (d)每组96小时内条件培养基的IFNγ浓度。
- (e)Luminex多重ELISA检测,对灌注对照T细胞或CAR-T细胞24、48、72和96 h的共混或顺序肿瘤球组的条件培养基进行检测。结果显示顺序肿瘤球组的CAR-T细胞的反应更强烈。
Discussion
肿瘤部位在体内是高度血管化的,因此,在探索药物输送到肿瘤、免疫细胞运输和免疫治疗的肿瘤研究中,必须使用含有更高比例的功能性血管的肿瘤模型系统。在以前的研究表明FB对体外肿瘤血管化有积极影响的基础上,作者发现在预先形成的肿瘤球中加入FB可以进一步改善体外的肿瘤血管化。
在顺序形成的肿瘤球中,FBs往往集中在肿瘤球状体的外围,因此它们能够更好地与微流控设备中周围细胞外基质中的ECs交流。这些FB可能提供生长因子,如血管内皮生长因子(VEGF)、成纤维细胞生长因子和血小板衍生的生长因子,以及基质基质,供ECs启动血管生成反应。相反,集中在共混肿瘤球中心的FB与周围血管的接触受到限制,导致在靠近肿瘤的地方形成的血管较少。
一在不同肿瘤细胞类型的肿瘤球中,FB的位置是不同的。即有可能出现在肿瘤球中心和均匀分布两种情况。这可能与粘附分子和运动蛋白相关。一种解释是,不同的肿瘤细胞系以独特的方式调节FB功能,例如,SN12C共混球体中的FB数量少于H69M或OV90共混肿瘤球,表明FB的增殖速度可能因肿瘤类型不同而受到不同调节。也有可能在不同的肿瘤细胞系中,粘附分子的类型和表达量不同,从而影响FB-FB与FB-肿瘤细胞的相对亲和力。不同肿瘤细胞系形成肿瘤球的相对能力清楚地表明了不同的TC-TC粘附特性。本研究中测试的大多数肿瘤细胞系都是起源于上皮细胞,因此E-钙粘蛋白(E-cadherin)的表达至关重要。另外,CD44家族的成员通常也很重要,并已被广泛研究。肿瘤细胞-FB和肿瘤细胞-基质的粘附是由多种粘附过程介导的,涉及整合素家族成员以及异型E-cadherin/N-cadherin键等。另一个因素是整合素的激活在调节细胞分泌的基质方面的作用。FB分泌的基质在ULA板中培养时为肿瘤和FB提供粘附部位。与这些基质相匹配的粘附分子的表达谱在这些肿瘤细胞系中可能有所不同。这种粘附分子的差异已被发现在形态发生中是至关重要的。
本研究另一个发现是,与共混组相比,顺序组有更多的对照T细胞和CAR-T细胞被招募到肿瘤区域。顺序肿瘤组的血管化水平提高和靠近肿瘤区域的灌注血管改善是一个促成因素。T细胞在连续流动的情况下通过这些血管被运送,在那里它们有更高的概率粘附和外渗到肿瘤区域。另一个可能的促成因素是免疫抑制性微环境尚未建立,因为只有人类正常肺部FBs被用来形成肿瘤球以测试CAR-T细胞的效率。可能这些FB还没有转化为免疫抑制的、与癌症相关的FB。
Luminex多重ELISA结果显示,相对于其他细胞因子,GM-CSF、IFNγ、IL-6和IL-8的分泌量很高。当CAR-T细胞被灌注到嵌有顺序肿瘤球的MVN中时,IL-6、IFNγ和GM-CSF的浓度要高于共混的肿瘤球。这种浓度差异可能是由肿瘤细胞相互作用依赖CAR-T细胞的激活造成的。如上所述,顺序肿瘤组中血管的增加导致了CAR-T细胞对肿瘤细胞的高可及性。这种相互作用导致了细胞因子分泌的增强。
尽管已经证明了顺序肿瘤球法有利于使用四种不同的肿瘤细胞系(SN12C、H69M、OV90和Skov3)的血管化,但这种顺序策略有局限性:
- 首先,这种方法需要一个预先形成的肿瘤球。如果肿瘤细胞不能自己形成球状体,如MD-MBA-231,这种顺序的肿瘤球方法就没什么效果。
- 其次,FB和肿瘤细胞之间的相互作用是动态的,顺序肿瘤球中的外围FB有可能继续演变,并接近于更类似于共混球体的分布。因此,为了从顺序法中有益的FB分布中获益,肿瘤球需要更早地被接种到微流控设备中,大约在2 d之内,以避免FB迁移到中心。然而,这么短的共培养时间会导致球状体不那么紧凑。
- 第三,在某些情况下(如HepG2和MCF7),FB会在短短24 h内从外围区域向内迁移。一旦发生这种情况,顺序法的好处就会减弱,血管化水平可能不会提高。在测试一种新类型的肿瘤细胞时,特别是对于原发性肿瘤样本,应该考虑所有这些限制,再用于这种血管化肿瘤芯片模型。
Conclusion
顺序添加的FB形成肿瘤球可以改善血管化,从而更好地模拟体内高度血管化的肿瘤微环境。
Reference
Wan Z, Floryan M A, Coughlin M F, et al. New Strategy for Promoting Vascularization in Tumor Spheroids in a Microfluidic Assay[J]. Advanced Healthcare Materials, 2022, 2201784.



