
一种研究头颈癌转移的体外TME平台。
Introduction
思路:
大多数头颈癌(head and neck cancer,HNC)产生于口腔、咽、喉和副鼻窦的鳞状细胞上皮,尽管有这种共同起源,但HNC在发病时的肿瘤分期、肿瘤的侵袭性、对治疗的反应以及区域和远处转移的风险等方面存在着明显的患者间的异质性。尽管采用了现代治疗方案,超过60%的患者仍患有复发或转移性疾病。最近的工作集中在各种癌症的肿瘤微环境(TME),研究其对促进疾病的影响。TME在转移中的作用仍不清楚,它代表了调节肿瘤行为和治疗反应的一种有希望的方法。在HNC中,肿瘤细胞向区域淋巴结的淋巴迁移是患者预后的一个有力指标。来自原发肿瘤和TME的分泌物也会产生肿瘤相关的淋巴管表型,表现出明显的细胞表面标志物的上调,这些标志物被认为是增加细胞向淋巴管的迁移。TME中细胞间信号传递的复杂性已经受到了极大的关注,但由于缺乏体外淋巴模型系统来研究这一过程,因此对淋巴管的可溶性因子信号传递的探索有限。
目前研究HNC的体外模型仅限于二维培养或简单的三维系统,主要使用细胞系来审视HNC生物学。此外,体内小鼠模型有助于评估治疗方法和HNC转移的动态变化,但异种移植研究的转化潜力有限,而且有很大的成本和时间负担。将原代细胞与扩大的TME结合在一起的三维肿瘤模型将有助于弥合原始的二维系统和更多的动物模型之间的差距。该设备包括一个胶原蛋白/纤维素ECM基质,内嵌患者来源的成纤维细胞、HNC肿瘤球体和淋巴微血管。与二维模型相比,由于基质细胞的存在,细胞与细胞之间通过物理接触的互动,以及更具代表性的可溶性因子信号,三维环境更好地再现了在体内观察到的行为。
人们对HNC TME中多种细胞类型之间的代谢关系了解甚少,尤其是在可溶性因子信号增加的情况下。光学代谢成像(OMI)是一种成像技术,可以在完整的三维样品中对单细胞水平的代谢进行量化。OMI使用双光子显微镜来测量两种代谢辅酶的自发荧光强度和寿命:
- 还原型烟酰胺腺嘌呤二核苷酸(NADH),一种存在于细胞质和线粒体的电子供体,在光谱上与其磷酸化形式(NADPH)重叠,统称为NAD(P)H;
- 氧化型黄素腺嘌呤二核苷酸(FAD),一种主要存在于线粒体的电子接受体。
NAD(P)H和FAD的荧光强度可用于计算光学氧化还原率(ORR = INAD(P)H/IFAD),从而深入了解单个细胞的氧化-还原状态。OMI可以检测到代谢途径依赖的转变(如糖酵解、氧化磷酸化),并已被用于研究各种疾病模型的代谢。
通过这个平台,作者探索了头颈癌细胞迁移的动态,以更好地了解TME中的支持细胞如何影响HNC的运动能力。
Tumor microenvironment enhances migration of head and neck cancer cells
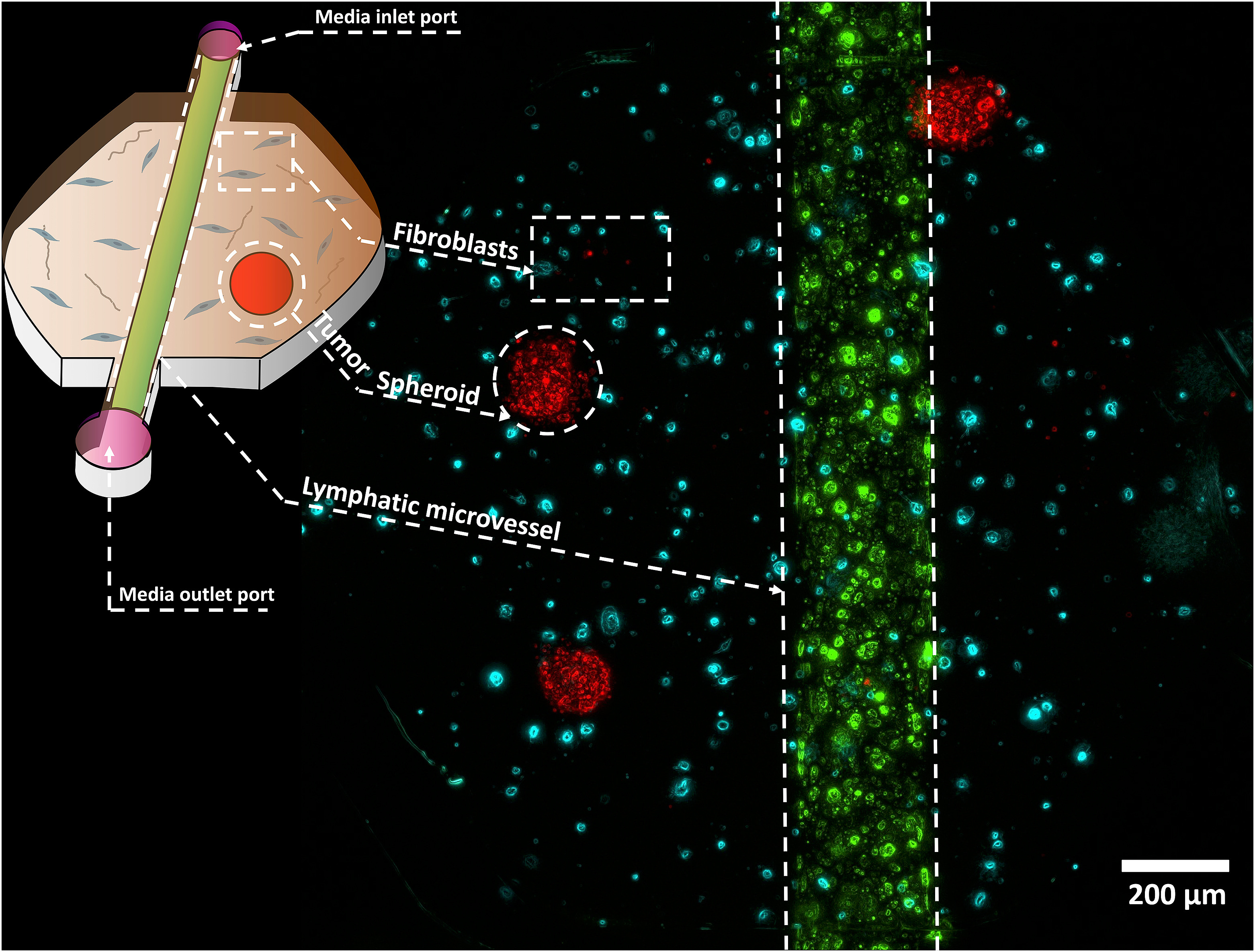
一个有代表性的单腔LumeNEXT设备,旁边有荧光标记的细胞,在胶原/纤维素ECM水凝胶中,嵌入了成纤维细胞(青色)、头颈癌肿瘤球体(红色)和一个衬有淋巴内皮细胞的微血管。(绿色)。
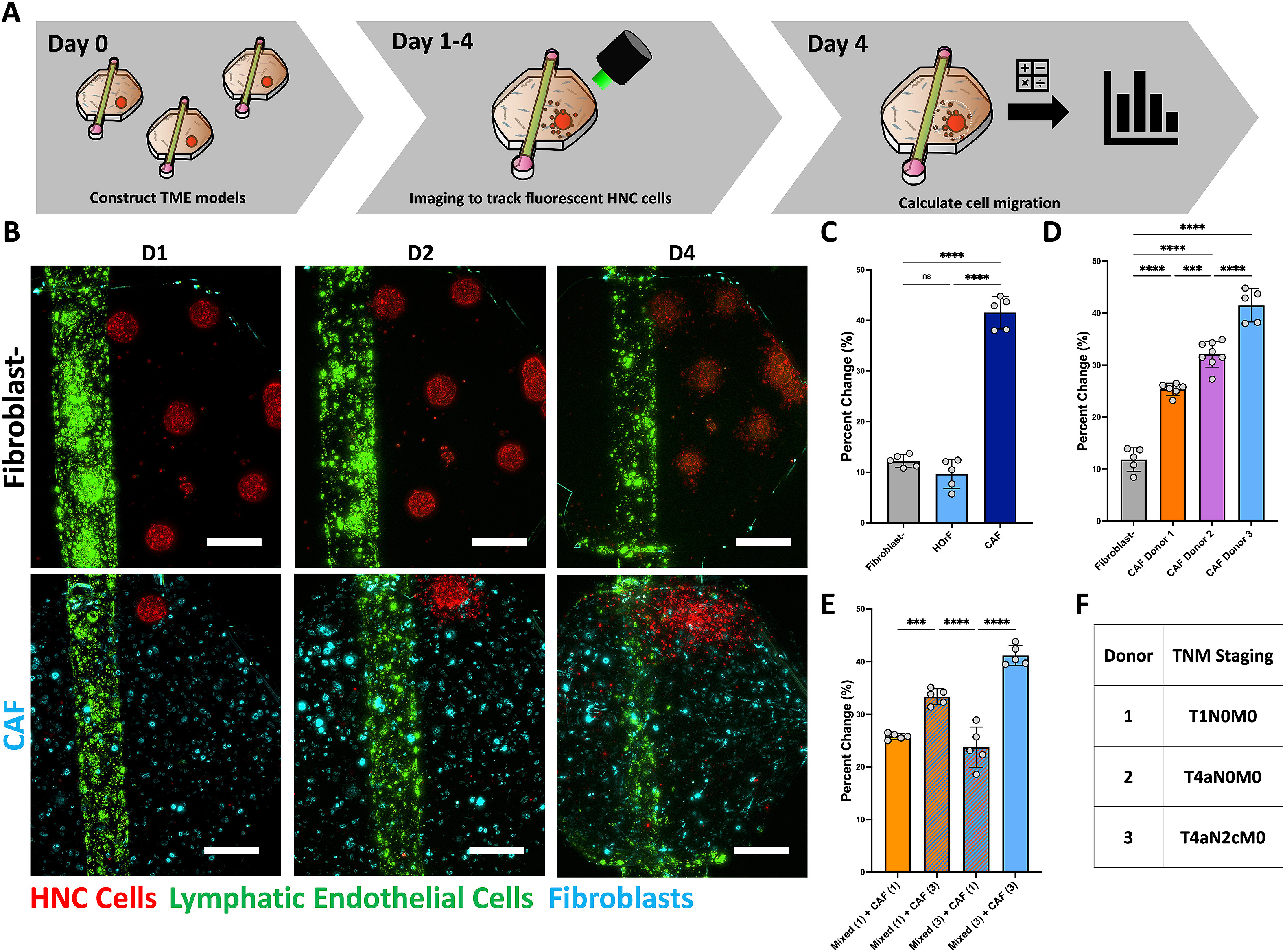
- (A)4 d迁移实验的时间轴示意图。
- (B)迁移实验的代表图像,比较HNC肿瘤球体(红色)与没有嵌入的成纤维细胞和癌症相关的成纤维细胞(青色)与淋巴微血管(绿色)的迁移。
- (C)当HNC细胞在没有任何成纤维细胞、人类口腔成纤维细胞和癌症相关成纤维细胞(CAFs)的情况下培养时,通过四 d的癌细胞覆盖面积的百分比变化来评估迁移的量化。
- (D)当与三个病人CAFs共同培养时,HNC细胞迁移的量化。
- (E)用来自最弱(供体1)和最强(供体3)诱导能力的CAFs与肿瘤混合形成的异型肿瘤球与来自同一供体或另一供体的CAFs进行混合和匹配迁移研究。含有嵌入ECM的供体3的CAFs的模型引起了最多的迁移,而嵌入供体1的CAFs的条件下迁移较少,这表明嵌入ECM的CAFs在通过分泌因子的产生而不是HNC细胞和成纤维细胞之间的物理相互作用驱动癌细胞迁移方面起了主导作用。
- (F)来自每个CAF供体的患者的TNM分期。
Influence of the tumor microenvironment on cytokine secretion
为了研究肿瘤ECM中细胞因子分泌的影响,有10个分析物被量化。其中,单核细胞迁移抑制因子(MIF)和白细胞介素6(IL-6)在肿瘤微环境中优先升高。在装置中包括的细胞类型中,HLECs对系统中MIF和IL-6的总体水平贡献最大,癌细胞和CAFs也有少量贡献。当HLECs与设备中的头颈癌细胞和CAFs共同培养时,MIF和IL-6的表达都明显增加。
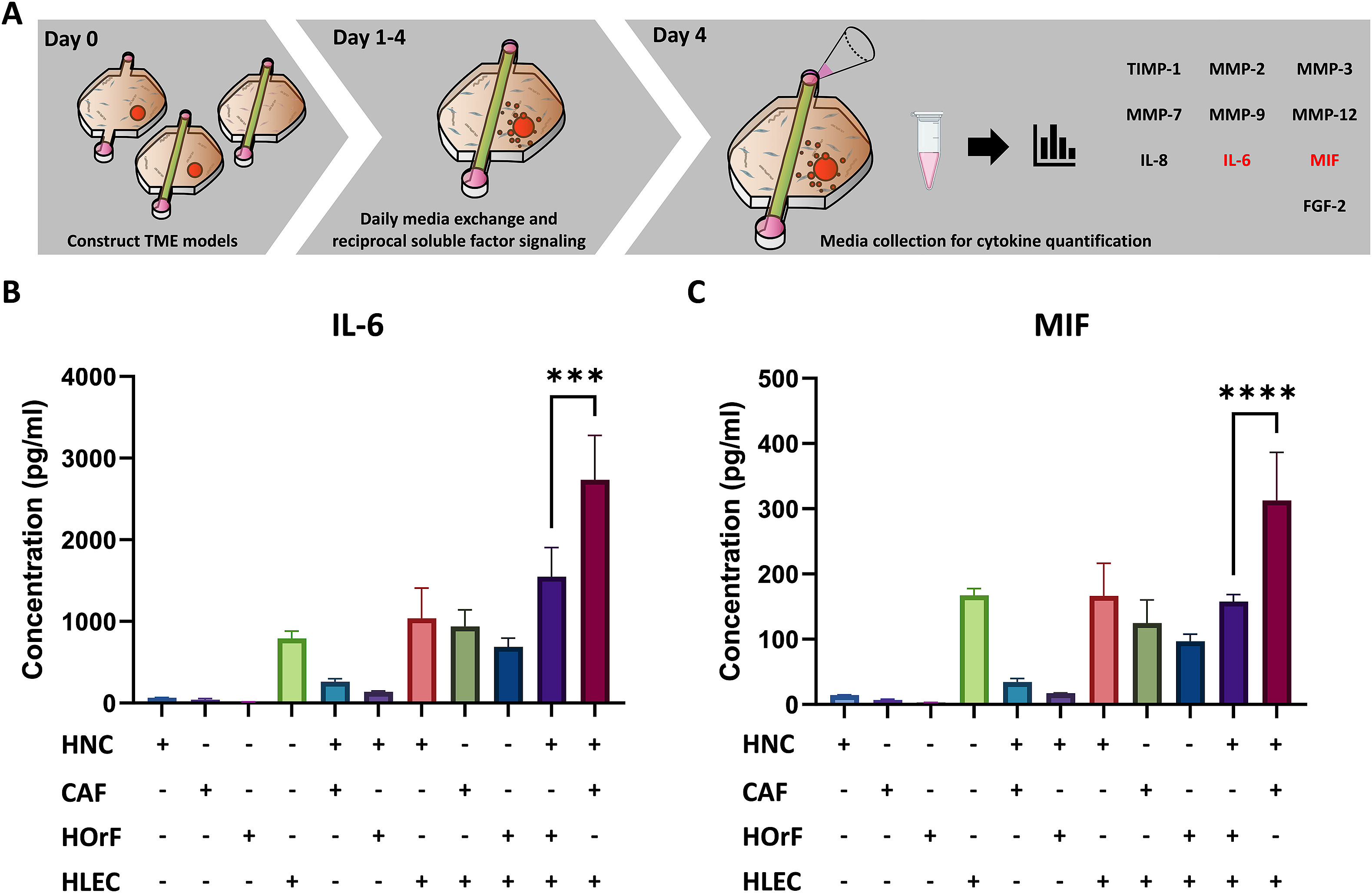
- (A)收集分析物的时间线示意图。
- (B-C)通过多重ELISA进行分析不同微环境模型条件下的(B)IL-6和(C)MIF的浓度,显示两者在肿瘤微环境中的升高。
Effect of IL-6 inhibition&MIF inhibition on head and neck cancer migration
随后使用常用的IL-6和IL-6受体(IL-6R)的中和抗体来研究IL-6在肿瘤微环境中上调的影响,以及为了研究MIF在调节HNC迁移中的作用,使用一种特征明确的抑制剂(ISO-1)。
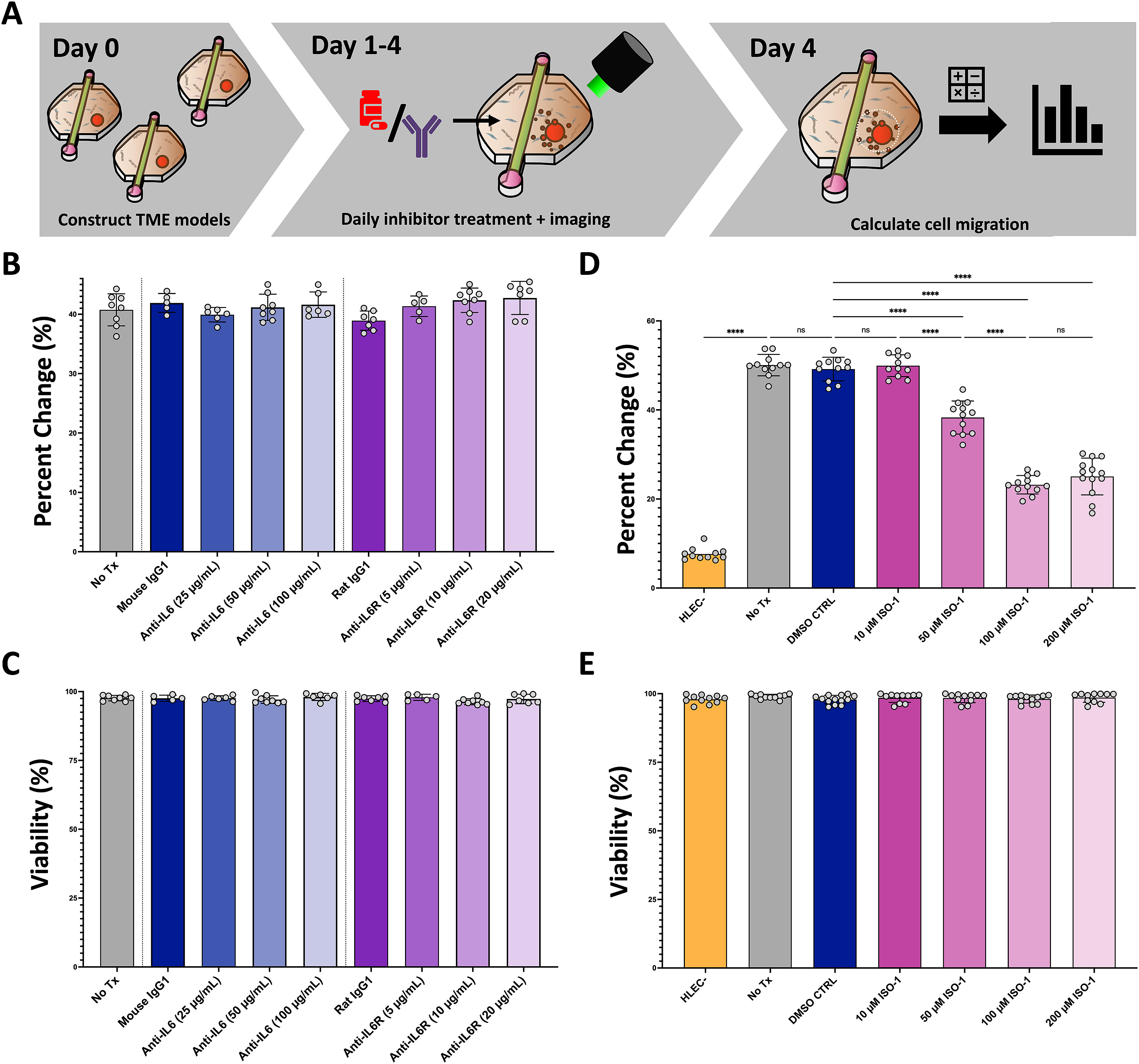
- (A)抑制剂研究的示意图。
- (B)用针对IL-6和IL-6R的抗体及其同型对照抗体小鼠IgG1和大鼠IgG1分别处理4 d后,通过评估癌细胞覆盖面积的百分比变化来量化迁移。结果显示,对HNC细胞迁移没有明显的影响。
- (C)IL-6和IL-6R抗体处理后的HNC细胞的活力,由Calcein AM和Ethidium homodimer测量。在所有测试条件下,癌细胞都能保持活力,没有明显的细胞死亡。结果表明,IL-6在驱动HNC细胞迁移方面没有起到作用。
- (D)用MIF抑制剂ISO-1处理后4 d的癌细胞覆盖面积的百分比变化来评估迁移的量化,以及与对照的量化。迁移与对照组相比明显减少,且具有明显的剂量相关性。
- (E)ISO-1处理后HNC细胞的活力,用Calcein AM和Ethidium homodimer测量。总的来说,对MIF的抑制导致了癌细胞迁移的明显减少,尽管没有下降到像HLEC耗尽条件下的最小MIF存在时的水平。
Tumor microenvironment influences the metabolic status of lymphatic endothelial cells and head and neck cancer cells
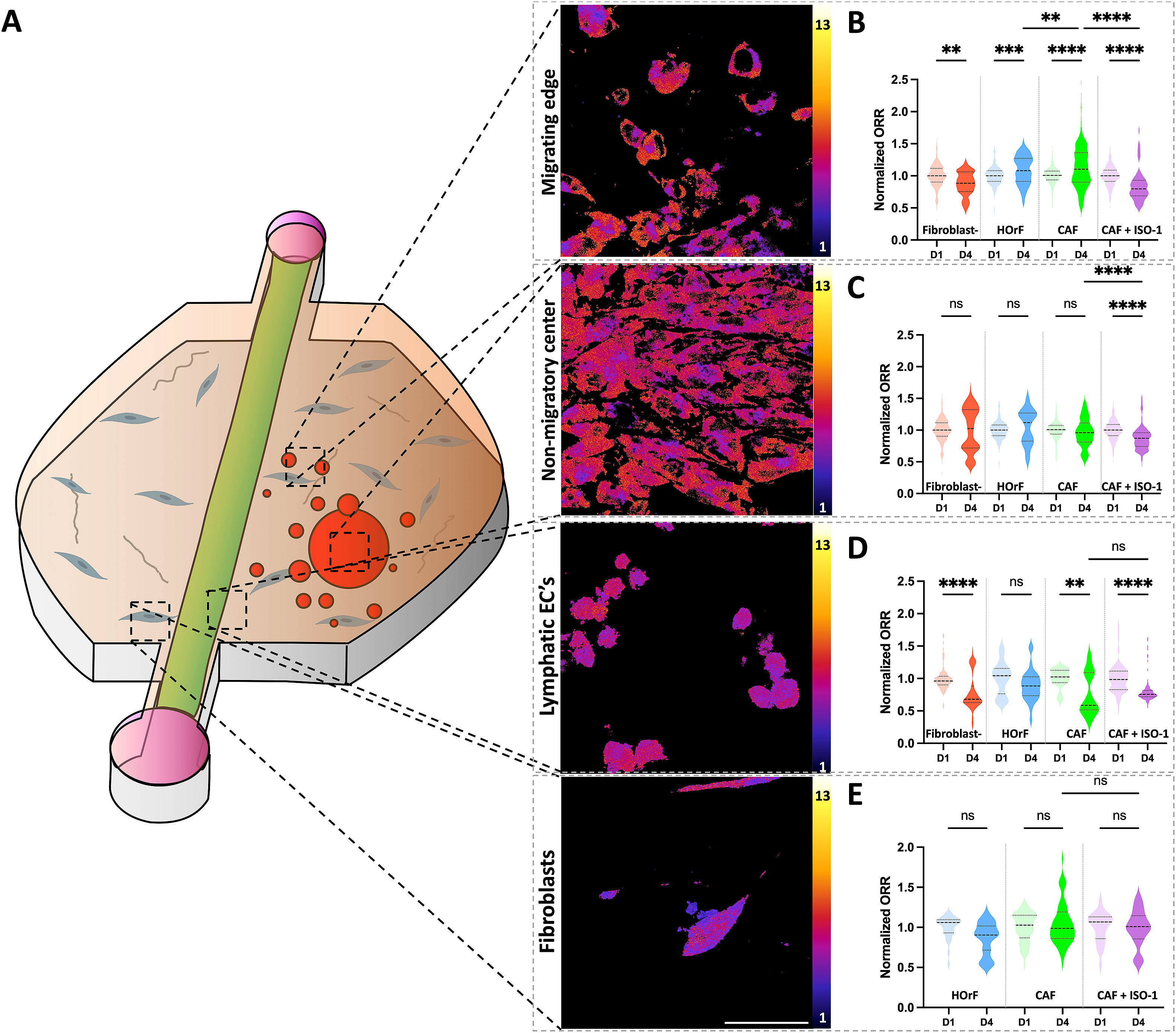
- (A)成纤维细胞、淋巴内皮细胞、肿瘤球中心的非迁移性HNC细胞和迁移性HNC细胞的光学氧化还原比率(NAD(P)H荧光强度/FAD荧光强度)的代表图像。
- (B-E)在不同的共培养条件下,用MIF抑制剂(ISO-1)处理后,(B)迁移走的HNC细胞、(C)肿瘤球体中的非迁移性HNC细胞、(D)淋巴内皮细胞和(E)成纤维细胞的标准化ORR。
- 当HOrFs、CAFs或没有成纤维细胞与淋巴微血管一起被嵌入ECM基质时,对这两个区间进行比较。对于迁移边缘的癌细胞,在没有成纤维细胞的条件下,从第1 d到第4 d的ORR下降,而在HOrF和CAF条件下则增加;
- 用100 μM的ISO-1处理后,与第1 d相比,第4 d迁移的癌细胞的ORR明显下降,这表明MIF在HNC的迁移和代谢中都起作用。不迁移的HNC细胞在第1 d和第4 d之间的ORR没有明显变化;
- 无CAF组+ISO-1,与第1 d相比,第4 d的ORR有所下降;
- 无CAF组中,HLECs的ORR在第4 d比第1 d下降,而在HOrF条件下没有明显变化;
- HLECs与CAFs共同培养,与第1 d相比,无论有无ISO-1,HLECs的ORR都有所下降;
- 嵌入ECM的HOrFs和CAFs的ORR没有明显变化,用ISO-1处理CAFs也不影响其ORR。
Effect of MIF on migratory and metabolic phenotype of HNC cells
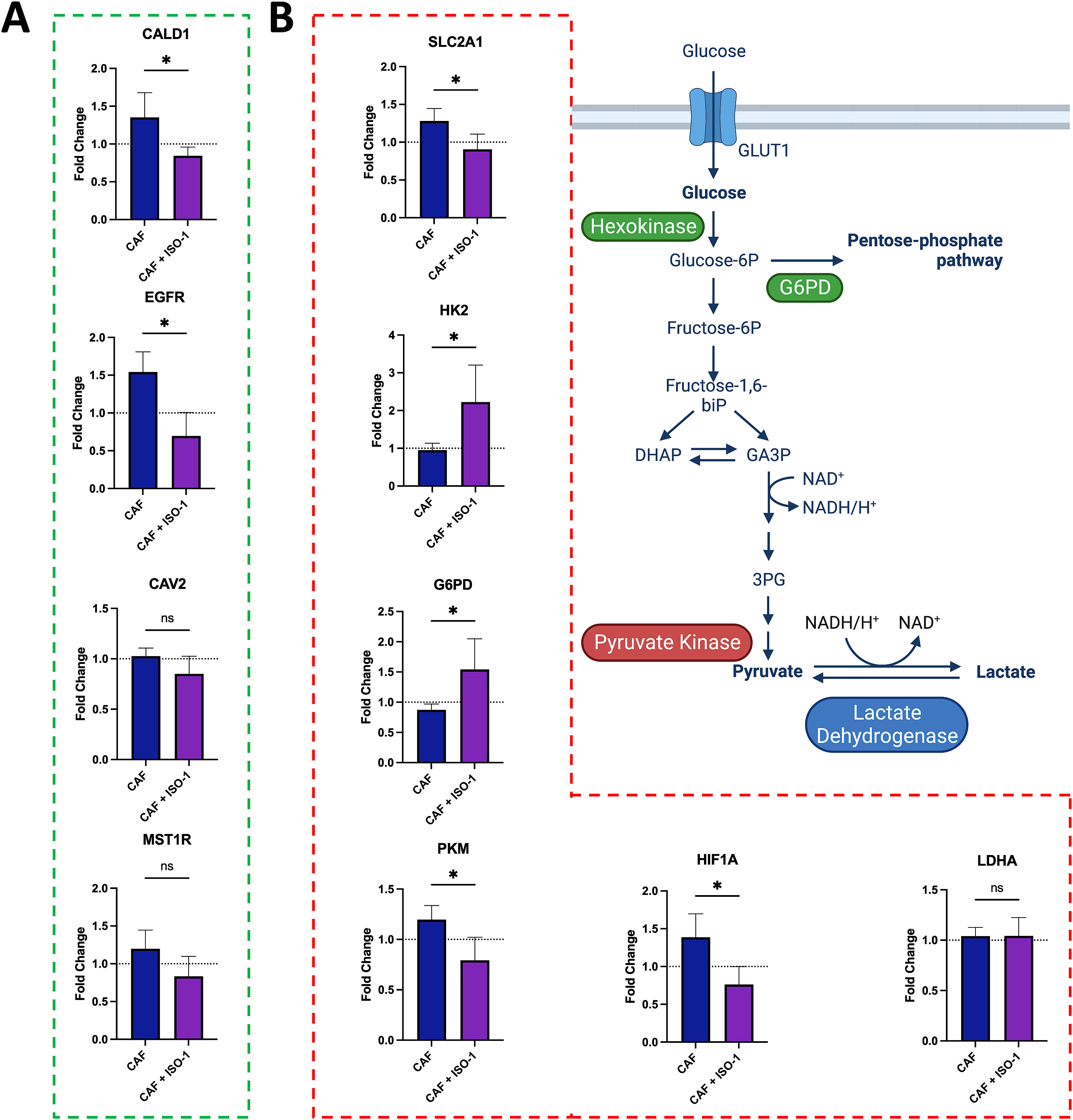
- (A)用100μM ISO-1处理后,在有HNC球、淋巴微血管和CAFs的装置中,与癌细胞迁移有关的基因表达的倍数变化。当MIF的活性被ISO-1耗尽时,与细胞增殖和迁移有关的基因,CALD1和EGFR被下调,而CAV2和MST1R没有变化。表明抑制MIF的活性会抑制与HNC运动有关的基因。
- (B)糖酵解途径的示意图,及与细胞代谢相关的基因表达量的倍数变化。在ISO-1处理后,六磷酸酶2(HK2)和葡萄糖-6-磷酸脱氢酶(G6PD)的表达增加,而GLUT1葡萄糖转运体(SLC2A1)、丙酮酸激酶(PKM)和缺氧诱导因子1-α(HIF1⍺)在接触ISO-1后被下调。用ISO-1处理后,乳酸脱氢酶A(LDHA)的表达没有变化。表明对糖酵解途径的依赖减少,与OMI的数据一致。
Discussion
- 肿瘤微环境直接影响头颈部癌症的迁移行为。在平台中加入CAFs诱导的迁移明显多于其正常对应物(HOrFs)。
- 通过ELISA确定了与HNC肿瘤微环境相关的两个分泌因子,IL-6和MIF。作者观察到淋巴内皮细胞与CAFs和肿瘤球体共培养时,相对于所有三种细胞类型的单培养,IL-6和MIF都有协同表达。这一重要发现进一步强调了淋巴在疾病进展中起着积极的作用,而不是在转移过程中的被动旁观者。这些结果进一步表明,淋巴管和TME中其他关键细胞类型之间的可溶性因子信号传递对更好地理解HNC至关重要,应包括在其中以创建更强大和生理相关的体外模型。
- 对IL-6和MIF的抑制研究对它们对HNC运动性的影响产生了不同的见解:
- MIF是典型的促炎症细胞因子,主要由免疫细胞(T细胞、嗜酸细胞、淋巴细胞、巨噬细胞等)表达。作者第一个报道淋巴内皮细胞分泌MIF。此外,作者观察到在MIF抑制剂ISO-1的作用下,癌细胞的迁移有剂量依赖性的减少。尽管ISO-1明显抑制了癌细胞的迁移,但MIF的抑制并没有抑制到在非肿瘤微环境条件下(无CAFs和淋巴微血管)观察到的迁移水平,这表明这里有没有确定的其他因素可能有助于癌细胞迁移。虽然IL-6/IL-6R的抑制没有改变癌细胞的迁移特征,但IL-6主要影响淋巴管的特征,包括渗透性和血管覆盖,这可能不会直接影响癌症的迁移,但可能影响最终癌细胞转移到淋巴管中。此外,HNC TME中IL-6的上调已被证明可以影响免疫细胞的招募和耗竭。
- 为了阐明MIF在促进HNC迁移中的作用,作者筛选了一系列与迁移和转移相关的基因。作者观察到在用ISO-1处理后有不同表达的基因,表明MIF影响了它们的表达。作者注意到,当细胞被ISO-1处理时,Caldesmon(CALD1)蛋白被下调。已知Caldesmon(CaD)能与肌动蛋白、滋养肌蛋白和钙调蛋白结合。主要是I-CaD异构体在非肌肉细胞中表达,并通过肌动蛋白细胞骨架的重组来调节细胞迁移。以前有报道称,CaD的表达水平影响HNC的TNM分期,CaD水平的增加与周膜侵袭和疾病进展的增加相关。作者假设,CaD活性的调节也可以由MIF的活性来解释。从机制上讲,MIF与其同源受体CD74/CD44结合,导致ERK/MAPK/MEK途径的激活,仅举几例。ERK已被证明可直接磷酸化I-CaD,以增强其在细胞骨架重塑中的活性,促进迁移和细胞分裂。除CaD外,ISO-1处理后,EGFR的表达也被削弱了。西妥昔单抗(抗EGFR)是第一个成功的HNC靶向治疗,EGFR在促进疾病进展和患者预后恶化方面的作用已被充分证明,但其与MIF的关系还不太清楚。作者的数据表明,MIF影响EGFR的表达,因为作者看到用ISO-1治疗后,EGFR的表达有所下降。MIF对EGFR表达的影响也突出了一种潜在的新型HNC治疗策略,即在传统化疗方案的同时加入MIF抑制剂。
- 该平台的设计和制造适合于双光子成像,以捕捉设备内细胞的代谢特征。淋巴内皮细胞对其共培养环境有代谢反应。当与CAFs一起培养时,淋巴细胞的ORR下降,但当与HOrFs一起嵌入时没有变化,这表明CAF共培养时有明显的代谢变化,可能与癌症相关的血管形成有关。使用OMI,作者证明添加CAFs影响了迁移的HNC细胞的代谢情况。与CAFs共培养4 d后,迁移的HNC细胞的ORR增加,表明它们增加了对糖酵解的依赖,而不是氧化磷酸化产生ATP。此外,以前的研究表明,更依赖糖酵解的癌细胞在适应pH值、氧张力和营养供应变化的能力方面更强。用ISO-1处理HNC细胞导致其ORR急剧下降,这与HNC细胞的迁移大幅减少相吻合。迁移的HNC细胞在与CAFs共培养4 d后,在有无ISO-1处理的情况下,其结合的NAD(P)H寿命成分(τ2)的变化也表明,MIF影响了HNC细胞在CAFs存在下的首选NAD(P)H结合伙伴。
- 作者试图通过基因表达分析进一步揭示MIF与迁移的HNC细胞的代谢状态之间的联系。因为用ISO-1处理后,设备的ORR下降是由NAD(P)H水平的下降驱动的,通常表明糖酵解的减少,所以作者关注与糖酵解途径有关的基因。在用ISO-1耗尽TME的MIF活性后,看到SLC2A1(GLUT1,葡萄糖转运体)的表达下降。葡萄糖进入细胞的穿梭次数减少可能解释了为什么迁移减少,因为已经证明迁移性或转移性细胞倾向于增加葡萄糖转运体的表达,以补偿运动所需的增加。糖酵解的第一步是由己糖激酶(HK2)将葡萄糖磷酸化为葡萄糖-6-磷酸,作者看到MIF抑制后HK2的表达量上升。尽管HK2参与了糖酵解的起始步骤,这通常表明糖酵解途径被激活,但作者也观察到氧化葡萄糖-6-磷酸的G6PD同时增加。这表明,葡萄糖正通过磷酸戊糖途径(PPP)从糖酵解中分流出来。磷酸戊糖途径产生核苷酸合成的前体,通常是细胞分裂和增殖的一个准备步骤。此外,减少对糖酵解的依赖是通过下调丙酮酸激酶(PKM)的表达而进一步确定的。丙酮酸激酶作用于糖酵解的最后一步,从磷酸烯醇丙酮酸生成丙酮酸。PKM表达的减少进一步表明发生的糖酵解减少。
- 除了糖酵解的特定基因外,作者看到HIF1-⍺的表达在ISO-1处理后下降。HIF1-⍺是应对缺氧的细胞平衡的主要调节器,具有广泛的多效性,包括血管生成、细胞凋亡和细胞代谢。HNC中HIF1-⍺的上调已被证明是更具侵略性的疾病和更差的患者预后。尽管MIF通过HIF1-⍺调节HNC代谢的确切机制尚不清楚,但MIF已被证明可以影响葡萄糖的关闭,并在肺癌中起到上调HIF1-⍺/NF-κB轴的作用。该轴的激活已被证明可以增强癌细胞的沃伯格效应。在其他癌症类型中,已经证明MIF可以帮助稳定HIF1-⍺以进一步促进其活性。作者假设HNC也可能有一套类似的级联。沃伯格效应的增强,经典的定义是增加对糖酵解的依赖而不是氧化磷酸化,如前所述,用ISO-1处理后ORR的下降进一步证实了这一点。消耗MIF的活性随后导致糖酵解减少,这表明MIF在改变HNC细胞的代谢状态方面起着作用,这种作用的一个途径可能是通过激活HIF1-⍺。
- 尽管三个不同的病人模型有一致的变化,但用基因表达数据来证实OMI数据还是有局限性。由于作者无法在模型中只分离出迁移性的癌细胞进行分析,所以依赖于大量的RNA分析,这与OMI提供的单细胞水平分析的强度不相符。尽管有这个限制,仍然能够检测到这些代谢途径中的几个推测基因的差异表达的重要信号。作者期望随着迁移性/转移性HNC细胞的细胞表面标志物的进一步定性,那么迁移性细胞的OMI和基因特征之间的直接比较可能成为现实。OMI研究的另一个注意事项是,它捕获了细胞在某一时间点的代谢状态。众所周知,癌细胞的代谢状况是动态的,细胞经常为了持续的细胞活动而转换对ATP生成方法的依赖。尽管有这种动态情况,作者仍然捕捉到了HNC细胞代谢变化的重要信号,这种变化是以共同培养的方式进行的,也受到MIF抑制的明显影响。
- 此外,作者预计这个平台将作为未来模型发展的一个基础。病人的免疫细胞可以被添加到该平台中,并扩大TME模型的复杂性。
Reference
Yada R C, Desa D E, Gillette A A, et al. Microphysiological head and neck cancer model identifies novel role of lymphatically secreted monocyte migration inhibitory factor in cancer cell migration and metabolism[J]. Biomaterials, 2023, 298: 122136.



