
一种芯片内多细胞共培养体系,结合间质流以促进神经祖细胞生存,神经发生与成熟。
Introduction
思路:
- 神经退行性疾病导致人类认知能力下降,通常是由于神经元死亡或功能障碍所致。基于神经干细胞/神经祖细胞(neural stem cells and neural progenitor cells,NSCs/NPCs)的疗法被提议作为神经退行性疾病的治疗方法,因为这些细胞具有通过神经元修复和替代改善患者大脑功能的潜力。因此必须更好地了解影响NSC/NPC命运和行为的生物和物理机制。
- 微血管能调节神经血管龛(neurovascular niche,NVN)中NSC/NPC的命运。内皮细胞是NSC/NPC自我更新和神经发生的协调者。在脑室下区(subventricular zone,SVZ)中,NPC(C型细胞)在进入神经发生或胶质细胞发生之前会在血管附近进行多轮细胞分裂,最终离开SVZ,沿着血管迁移到嗅球,在那里进一步分化为成熟的神经元。
- 在过去十年中,人类NVN的体外模型得到了发展。然而,使用二维(2D)基质的培养物不能正确再现SVZ和颗粒下层(subgranular zone,SGZ)的细胞结构。使用三维水凝胶或细胞球的模型能更有效地复制NSCs/NPCs和内皮细胞之间复杂的细胞相互作用。然而,这些模型缺乏某些物理刺激,如血管内的管腔流和通过细胞外基质(ECM)的间质流(IF)。在大脑中,IF 可促进血管和神经细胞的相互作用、代谢物和生长因子的长距离运输,以及通过淋巴系统清除大分子废物。此外,中频的机械刺激还能调节细胞基因和蛋白质的表达,尤其是在微血管形成的过程中。一旦实现血管吻合,血管内血流对血管特性起着重要作用。除了输送氧气和营养物质外,血流还对血管壁产生剪切应力。这改变了内皮细胞基因表达和血管功能,包括调节血管龛中干细胞的行为。此外,内皮细胞的低通透性是血脑屏障(BBB)的一个重要特征,它将血液成分与脑组织区隔开来。在体外再现这些物理刺激和细胞结构对于开发生理上准确的人类NVN模型至关重要。
- 由于微流控设备(MFDs)能对生化和物理变量进行时空控制,因此已成为模拟内皮细胞和非小体干细胞/全坏死细胞之间相互作用的流行系统。然而迄今为止还没有研究调查过间质液体的大量流动对NSC/NPC命运的影响。因此,目前还没有一种微流控模型能完全再现人体NVN的细胞结构和物理刺激。
NPCs were capable of self-renewal, neurogenesis, and astrogenesis in 2D cell culture
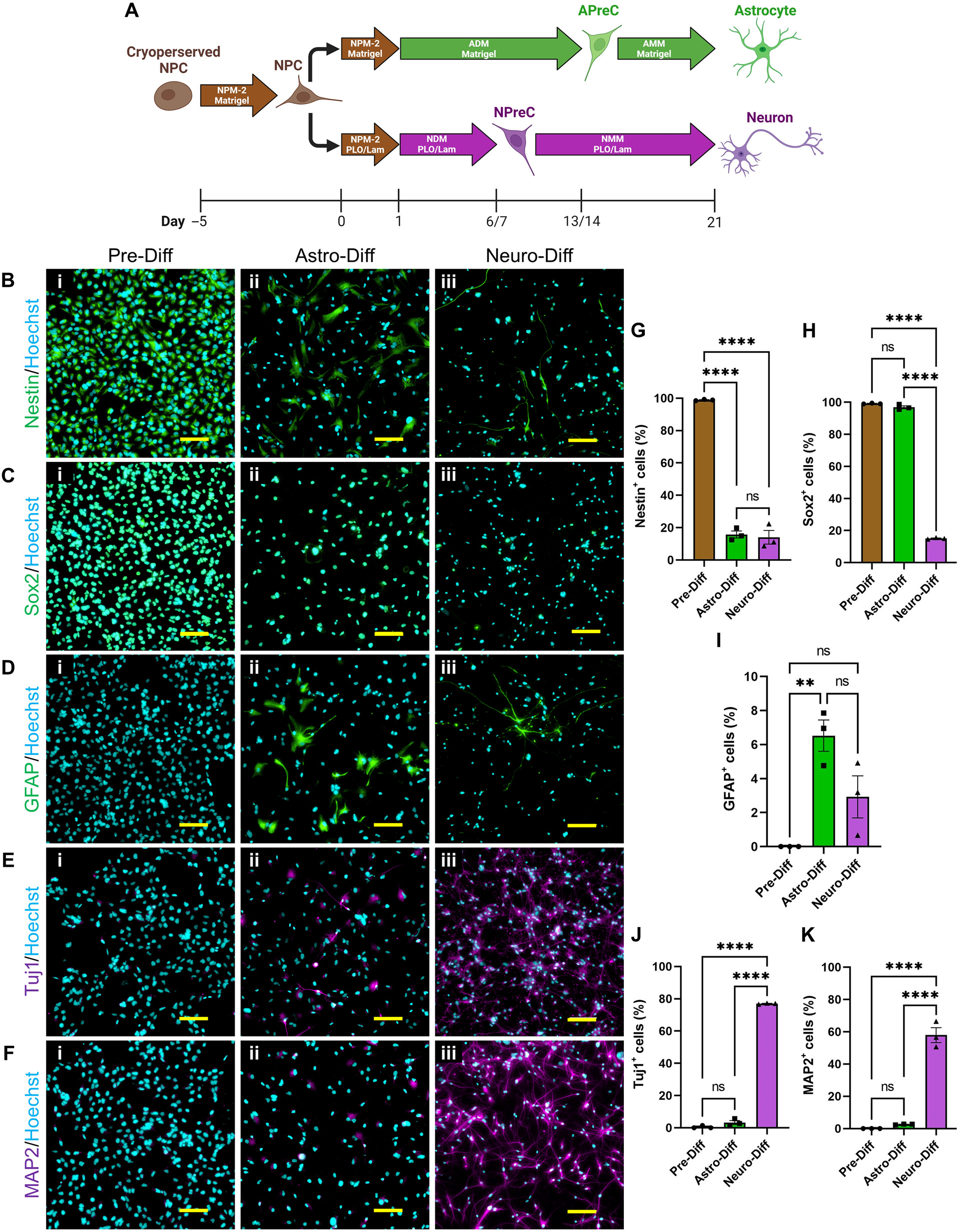
- (A)NPC在二维细胞培养中的分化示意图。
- 在星形胶质细胞分化方案中,星形胶质细胞分化培养基(ADM)用于将NPC转化为星形胶质细胞前体细胞(APreCs)。然后用星形胶质细胞成熟培养基(AMM)将APreCs转化为NPC衍生的星形胶质细胞(NPC-ACs);
- 在神经元分化方案中,使用神经元分化培养基(NDM)将NPCs转化为NPreCs。然后使用神经元成熟培养基(NMM)将NPreCs转化为 NPC 衍生神经元(NPC-neurons)。两种分化培养都在第21 d终止。培养皿涂有Matrigel或聚鸟氨酸和层粘连蛋白(PLO/Lam)。
- (B-F)NPC分化的免疫细胞化学分析。在任何分化之前(Pre-Diff,i)以及星形胶质细胞(Astro-Diff,ii)和神经元(Neuro-Diff,iii)分化之后,对细胞进行免疫荧光标记,包括神经干细胞标记物nestin(B,绿色)和Sox2(C,绿色)、AC标记物GFAP(D,绿色)以及神经元标记物Tuj1(E,紫色)和MAP2(F,紫色)。细胞核用 Hoechst(蓝色)标记。
- (G-K)图表显示在Pre-Diff、Astro-Diff和Neuro-Diff培养物中表达nestin (G)、Sox2 (H)、GFAP (I)、Tuj1 (J)和MAP2 (K)的细胞总数百分比。这些结果表明,XCL-1衍生的NPC具有自我更新特性,并能在二维细胞培养中,在确定的培养基条件下分化成NPC-AC和NPC-神经元。
NPCs did not survive solo-culture in MFDs

- (A)MFDs中分散的NPC单独培养图解。在MFDs中,NPC以三种不同的细胞密度重悬于纤维蛋白凝胶(NPC条件)中。样本在 EGM-2:NPM-2流动条件下培养1 w。
- (B)不同细胞密度下,第1 d和第7 d NPC 的活(绿色)/死(红色)染色。
- (C)活死染色量化结果。结果表明,MFDs内的单独培养条件不利于NPC的存活和增殖。
- (D)NPC-ZsG-Nsph在MFDs中单独培养的示意图。将NPCs-ZsG聚集成三种不同细胞密度的神经球,并重新悬浮在MFDs内的纤维蛋白凝胶(NPC条件)中。细胞在EGM-2:NPM-2流动条件下培养1 w。
- (E)第1 d和第 7 d在MFDs中培养的NPC-ZsG-Nsphs(ZsGreen1,绿色)的荧光图。
- (F-G)显示了所有神经球密度的神经球面积从第1 d到第7 d的变化(F)和第7 d/第1 d神经球面积比(G)。
ZsG:ZsGreen1,一种绿色荧光蛋白。
NPC survival was enhanced by coculture with BMVNs in MFDs

- (A)用于研究NPC-Nsph扩增的培养方案图解。简而言之,将表达ZsGreen1的NPC(NPCs-ZsG)聚集成神经球(NPC-ZsG-Nsphs,每个Nsph有200个NPC-ZsG),并在MFDs内的纤维蛋白凝胶中单独培养(NPC 条件)、与PCs一起培养(NPC-PC 条件)、与ACs一起培养(NPC-AC 条件)、与BECs-tdT一起培养(NPC-BEC 条件)以及与所有三种细胞类型一起培养(NPC-BEC-PC-AC 条件)。样品在 EGM-2:NPM-2 流动条件下培养 1 周。插图仅显示 NPC-BEC-PC-AC 条件。
- (B)在NPC、NPC-PC、NPC-AC、NPC-BEC和NPC-BEC-PC-AC条件下培养的NPC-ZsG-Nsphs (ZsGreen1,绿色)在第1 d和第 7 d的荧光图。BECs-tdT微血管(tdTomato,红色)仅在第7 d成像。PC和AC未显示。
- (C-D)显示所有条件下神经球面积从第1 d到第7 d的变化(C)和第7 d/第 1 d神经球面积比(D)。
- (E-F)第7 d,在NPC-BEC-PC-AC条件下,表达Sox2(E,紫色)和Ki67(F,紫色)的NPC-ZsG-Nsphs(ZsGreen1,绿色)与微血管(tdTomato,红色)的荧光图。细胞核用Hoechst(蓝色)标记。这些结果证明了用BMVNs培养NPC可以在类似人类NVN的体外微环境中产生分裂、自我更新的神经细胞。
BECs:brain endothelial cells;
PCs:pericytes;
ACs:astrocytes。
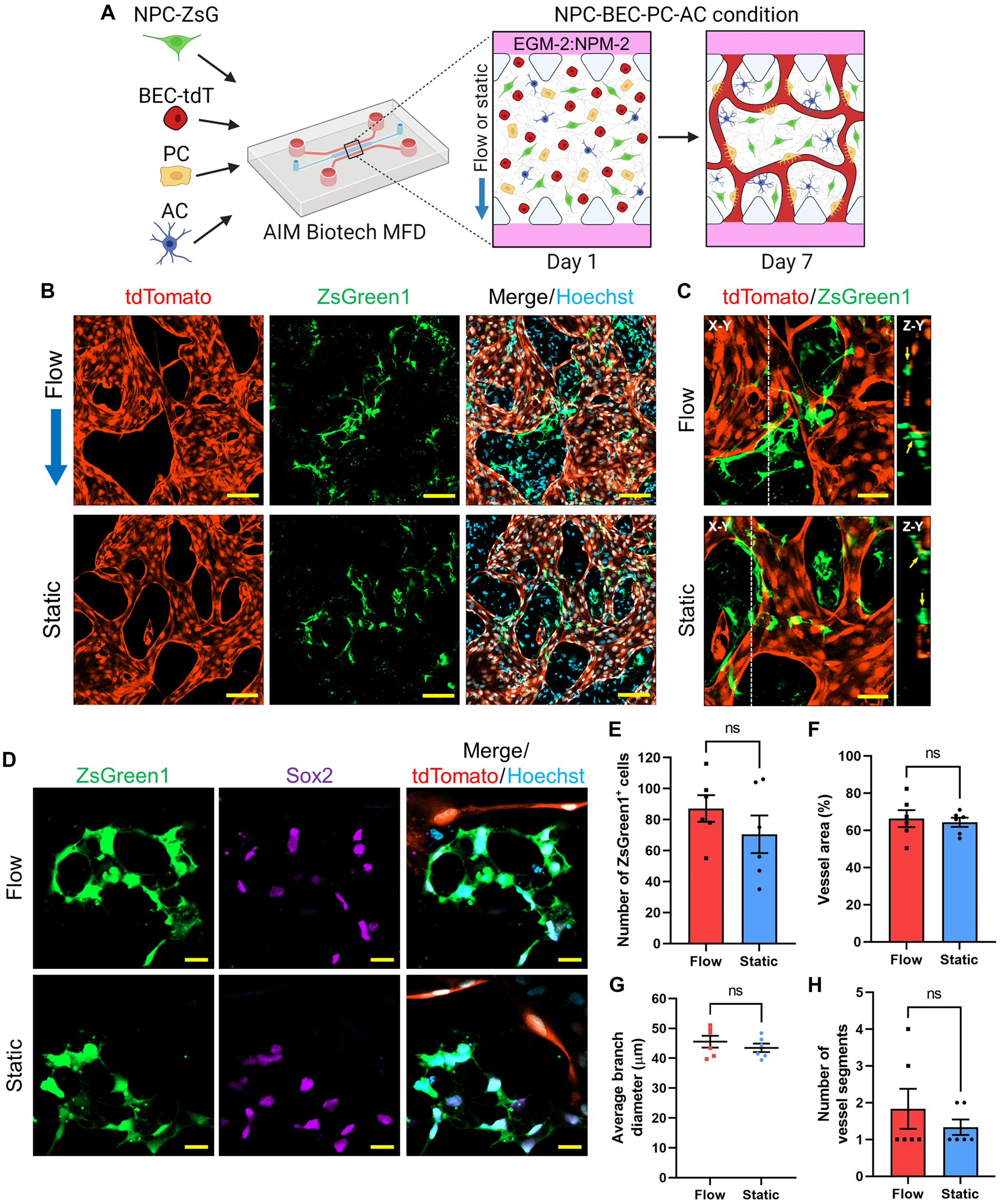
- (A)用于研究IF对MFD中分散NPC与BMVNs扩增的影响的培养方案图解。简而言之,表达ZsGreen1的NPCs(NPCs-ZsG)与BECs-tdT、PCs和ACs(NPC-BEC-PC-AC 条件)一起在纤维蛋白凝胶中的MFDs中培养。样品在EGM-2:NPM-2流动或静止条件下培养1 w。
- (B)在流动和静止条件下培养的NPC-BEC-PC-AC第7 d的荧光共聚焦图。分别用ZsGreen1(绿色)和tdTomato(红色)标记NPCs-ZsG和BECs-tdT。细胞核用Hoechst(蓝色)标记。蓝色箭头表示流动条件下IF的方向。
- (C)在流动和静止条件下,NPCs-ZsG(ZsGreen1,绿色)与中空微血管(tdTomato,红色)直接接触的荧光共聚焦图(X-Y)。白色虚线表示Z-Y截面。
- (D)在流动和静止条件下,表达Sox2(紫色)的NPCs-ZsG(ZsGreen1,绿色)靠近微血管(tdTomato,红色)的荧光共聚焦图像。细胞核用Hoechst(蓝色)标记。
- (E-H)显示了第7 d流动和静止条件下样本特定区域内ZsGreen1+细胞的数量(E),以及血管面积(F)、平均分支直径(G)和血管节段数量(H)。这些数据共同表明,IF对微血管形态没有影响。
NPreC neurogenesis was enhanced by coculture with BMVNs in MFDs

- (A)用于研究NPreC-Nsph神经发生的培养方案图解。简而言之,NPreC-Nsphs分别单独培养(NPreC条件)、与PCs一起培养(NPreC-PC条件)、与ACs一起培养(NPreC-AC条件)、与BECs-tdT一起培养(NPreC-BEC条件)以及与所有三种细胞类型一起培养(NPreC-BEC-PC-AC条件)。样品在EGM-2:NMM流动条件下培养 10 d。插图仅显示NPreC-BEC-PC-AC条件。
- (B) 第1 d NPreC-Nsphs在所有条件下的相位/荧光图像。黄色箭头标记NPreC-Nsphs。BECs-tdT表达tdTomato(红色)。
- (C)第10 d所有条件下NPreC-Nsphs的荧光共聚焦MIPs。NPC神经元用Tuj1(绿色)和Hoechst(蓝色)标记。未显示BECs-tdT、PCs和ACs。黄色虚线勾勒出神经球核心。
- (D)NPreC-Nsphs(Tuj1,紫色)在所有条件下的大荧光共聚焦显微图。去除背景信号以突出神经元。
- (E-G)显示了第10 d所有条件下NPreC-Nsphs测得的神经球核心面积(E)、神经元总生长量(F)和最大神经元延伸量(G)。这些结果共同表明,BECs-tdT可能是神经球中NPreC增殖和神经发生的主要原因。与NPreC-BEC条件相比,在NPreC-BEC-PC-AC条件下观察到的神经球核心面积明显较小,这可能是由于在四重培养条件下细胞总数较多,对营养物质和生长因子的竞争更加激烈。

- (A)NPreC-Nsphs (每个Nsphs 含400 个NPreCs)单独培养(NPreC条件)和与 BECs、PCs 和 ACs 一起培养(NPreC-BEC-PC-AC 条件)的相位/荧光图像。蓝色箭头表示两种条件下 IF 的方向。
- (B)第10 d NPreC(i)和NPreC-BEC-PC-AC(ii)条件下NPreC-Nsph(CellTracker Red,红色)切片的荧光延时共聚焦显微图。样本用Fluo-8(绿色)染色,以观察细胞内钙的波动。黄色三角形表示成像过程中出现钙振荡的NPC神经元。
- (C)在两种培养条件下,用Fluo-8(绿色)染色的单个NPC神经元(CellTracker Red,红色)的荧光延时共聚焦图像。蓝色圆圈标识下图(D)中用于测量Fluo-8强度的NPC神经元细胞体。
- (D)图(C)中确定的NPC神经元的Fluo-8荧光强度相对于初始值(∆F/F0)的变化图。
- (E-F)在NPreC和NPreC-BEC-PC-AC条件下,每个神经球切片测得的放电NPC神经元数量(E)和每分钟总尖峰计数(F)图。这些数据共同表明,与单独培养的NPreC-Nsphs相比,与BMVNs一起培养的NPreC-Nsphs能够产生明显更多的放电NPC神经元,且放电率更高。与图F得出的结论一致,即BECs-tdT、PCs和ACs的存在增强了NPreC的神经发生。
Fluo-8:钙离子探针。
IF enhanced neurogenesis of NPreCs cocultured with BMVNs in MFDs
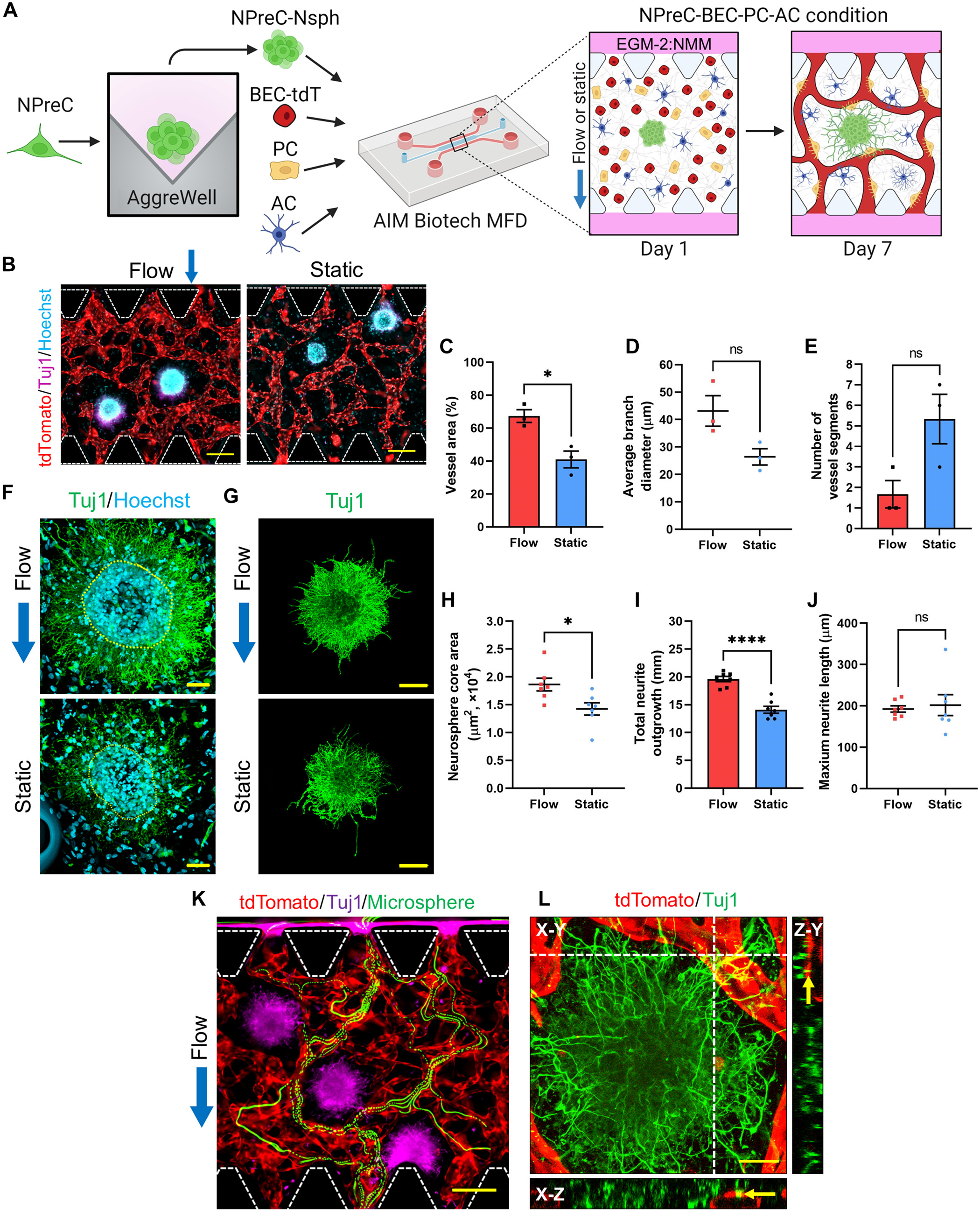
- (A)所用培养方案图解。
- (B)第7 d,由BECs-tdT组成的BMVNs支持的NPreC-Nsphs(Tuj1,紫色)在流动或静止条件下的荧光显微图(tdTomato,红色)。未显示PC和AC。细胞核用 Hoechst(蓝色)标记。
- (C-E)显示微血管测量的血管面积(C)、平均分支直径(D)和血管节段数量(E)。
- (F)第7 d用 BMVNs 培养的NPreC-Nsphs的荧光共聚焦显微图。NPC神经元用Tuj1(绿色)和Hoechst(蓝色)标记。黄色虚线勾勒出神经球核。
- (G)NPreC-Nsphs(Tuj1,绿色)的大荧光共聚焦显微图。去除背景信号以突出神经元。
- (H-J)显示了NPreC-Nsphs测得的神经球核面积(H)、神经元总生长量(I)和最大神经元延伸量(J)。这些数据共同表明,在四联培养过程中应用IF有利于NPreC-Nsph 的神经发生。通过纤维蛋白凝胶的大量液体运动为神经球提供了充足的可溶性生长因子,使其能够进行神经元分化并延伸出健康的神经元。
- (K)第7 d的流动条件下,微球(绿色)流经支持NPreC-Nsphs (Tuj1,紫色)的微血管(tdTomato,红色)的荧光延时显微图。
- (L)流动条件下NPC神经元(Tuj1,绿色)与微血管(tdTomato,红色)的荧光共聚焦 MIP。
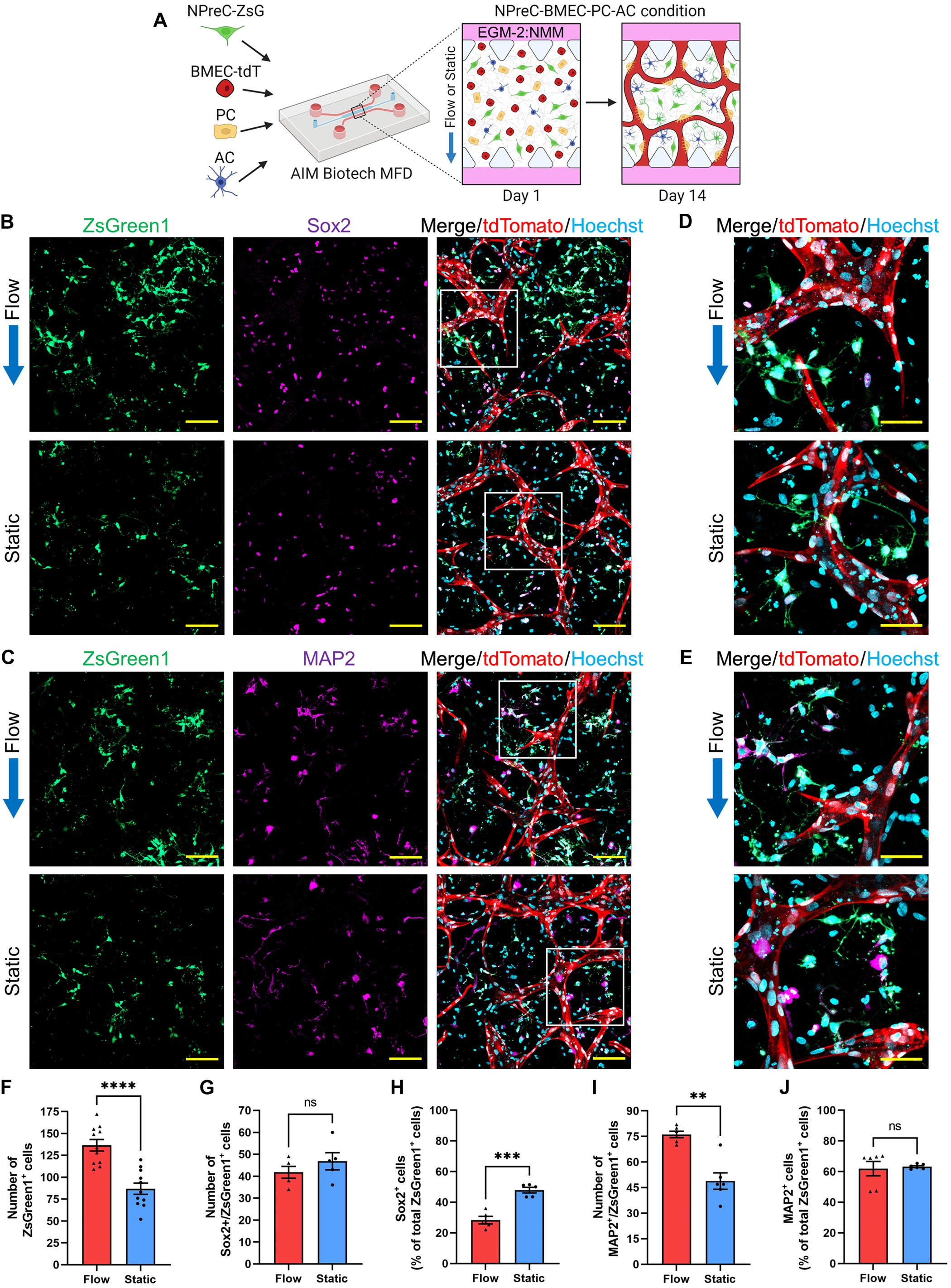
- (A)用于研究IF对分散NPreC自我更新和神经发生影响的培养方案图解。简而言之,表达ZsGreen1的NPreCs(NPreCs-ZsG)与BMECs-tdT、PCs和ACs一起在MFDs内的纤维蛋白凝胶中培养。样品在EGM-2:NMM中流动或静止培养 2 w。
- (B-C)第14 d,表达Sox2(B,紫色)和MAP2(C,紫色)的NPreCs-ZsG(ZsGreen1,绿色)与BMVNs在流动和静止条件下的荧光共聚焦显微图像。合并图像中的白色方块在下一子图中展开。
- (D-E)第14 d,在流动和静止条件下,表达Sox2(D,紫色)和MAP2(E,紫色)的NPreCs-ZsG(ZsGreen1,绿色)的放大图像。
- (F-J)第14 d在流动和静态样本中测得的ZsGreen1+细胞数(F)、Sox2+/ZsGreen1+细胞数(G)和百分比(H)以及MAP2+/ZsGreen1+细胞数(I)和百分比(J)的图表。这些数据表明,IF增加了四联培养中 MAP2+/ZsGreen1+ 细胞的总数,但并没有增加表达 MAP2的NPreCs-ZsG的百分比,这表明IF主要通过增加细胞增殖总数来促进神经发生,然后向神经元系分化,从而产生更多的神经元,而不是偏向分化的百分比。
Discussion
- 在所有实验中都使用了多能干细胞XCL-1衍生的NPC,因为它们能产生同质的nestin+/Sox2+细胞群,并能扩增多达10次传代并保持分化潜力。免疫细胞化学分析证实,在任何分化方案之前,几乎所有NPC中都存在nestin和Sox2。大多数NPC在神经元分化后不表达任何一种干细胞标记物,证实了NSC/NPC在神经元分化过程中显著下调nestin和Sox2表达的趋势。在星形胶质细胞分化方案实施21 d后,大多数NPC-ACs仍表达Sox2,只有不到10%表达GFAP,这表明它们仍具有干细胞样特征。不过,这可能是由于星形胶质细胞分化方案的时间相对较短。
- 在三维纤维蛋白基质中单独培养约一周后,大多数分散的NPC死亡。LIVE/DEAD分析证实,提高NPC播种密度、在ECM中添加Matrigel、从培养基中移除EGM-2以及终止IF都不能提高NPC的存活率。结论是,MFD内默认的微环境条件不利于分散的NPC存活。以前的研究发现,将NSCs/NPCs聚集成神经球可促进细胞增殖,提高细胞活力和代谢活性。基于这些原因预计NPC-ZsG-Nsphs的存活时间会比分散的NPC长。然而,无论NPC-ZsG密度如何,将NPCs-ZsG培养成神经球也不会提高NPC在MFDs中的存活率。
- 假设在MFDs中将NPC与BMVNs共同培养时,NPC的存活率会大大提高。随后发现,与单独培养的NPC-ZsG-Nsphs相比,NPC-ZsG-Nsphs与BECs-tdT、PCs或ACs单独共培养以及与所有三种细胞类型一起共培养时,神经球的生长也会增强。然而,在NPC-BEC和NPC-BEC-PC-AC条件下观察到的神经球面积增幅最大,这强调了BECs-tdT对NPC-ZsG存活和扩增的血管贡献。四联培养中的神经球同时表达了Sox2和Ki67,证实了NPCs-ZsG正在积极地进行自我更新和有丝分裂。总之,这表明神经球的扩大是细胞增殖的产物,而不仅仅是NPCs-ZsG迁移到纤维蛋白凝胶中。作者发现,在NPC-BEC-PC-AC和NPC-HUVEC-PC-AC条件下,NPC-ZsG-Nsphs的神经球扩增没有差异。总之,神经球扩增实验结果证明了内皮细胞的神经营养作用,并证明了选择原代BECs在体外再现人类NVN的合理性。
- 在确认了NPC-ZsG-Nsphs与BECs-tdT、PCs和 ACs共同培养的益处后,在流动和静态条件下使用EGM-2:NPM-2将分散的NPCs-ZsG与BMVNs共同培养,以确定IF对NPCs-ZsG增殖和自我更新的影响。发现IF对四联培养样本中的微血管形态没有影响,在这项研究中,NPM-2中额外存在的碱性成纤维细胞生长因子(bFGF)和EGF对微血管形态的影响可能达到了一定程度,从而掩盖了IF的作用。此外,观察到在流动和静止条件下 ZsGreen1+细胞的平均数量没有明显差异,这表明IF对在EGM-2:NPM-2中培养的四联培养物中 NPC-ZsG 的存活没有影响。
- 与单独培养的NPreC-Nsphs相比,当神经球与BECs、PCs或ACs单独共培养时,以及与所有这三种细胞一起共培养时,NPreC-Nsphs的神经发生(以神经元的总延伸率来衡量)得到了增强。
- 当NPreC-Nsphs 与BECs-tdT、PCs和ACs在流动条件下共培养时,观察到灌注BMVN的形成。这表明在实现BMVN吻合后,诱导IF穿过纤维蛋白凝胶的静水压梯度也促进了血管内流动。作者假设,IF以及微血管管腔内的流动将有利于NPreC-Nsph神经发生。灌注的微血管可能有助于向位于纤维蛋白凝胶内部的NPreC-Nsph输送营养和分化生长因子。由于NPreC-BEC-PC-AC条件下的细胞总密度相对较高,血管输送可能减轻了细胞竞争的负面影响。在流动和静态条件下,将NPreC-Nsphs与BMVNs一起培养,可以明显看出应用IF对神经发生的益处。1 w后,流动条件下形成的血管覆盖面积明显大于静态条件下生长的微血管,这可能是由于只有在流动样本中才存在微血管灌注。此外还发现在流动条件下,平均神经球核面积和神经元生长总量都有所增加。作者推测,神经球尺寸和神经元延伸的增加是水凝胶通道中IF的结果。这并不是说间质液体的大量流动提供了机械刺激,从而加速了神经元的分化。相反,IF在提供营养和清除废物方面可能比简单的扩散更有效。因此,在流动条件下,由于传导运输的作用,分化培养基中生长因子的生物利用率可能更高。
- 对单独培养和四联培养NPreC-Nsphs的Ca2+振荡分析揭示了NPC神经元在体外的神经元功能。在单独培养的神经球中,很少观察到NPC神经元的自发神经元活动。相反,在与BMVNs共同培养的神经球中,我们通常能发现几个放电的NPC神经元。所有放电的NPC神经元都位于NPreC-Nsphs的外周附近。不过,考虑到与神经球中心相比,神经球的边缘可能更容易让NPC神经元获得可溶性神经营养素,并且有更多的物理空间来延伸神经元,因此这并不出乎意料。在NPreC-Nsphs中观察到的Ca2+浓度动态的时间尺度与体外培养的神经元的时间尺度相似。与 NPreC 条件相比,在NPreC-BEC-PC-AC条件下培养的神经球中发射细胞的数量和每分钟的总尖峰数明显更高。这些数据强调了 BMVNs 在体外功能神经元发育中的有益作用,这已在之前的一些研究中得到证实。W该实验证明了四重培养模型的有效性,它能在类似于NVN的微环境中测量BMVN对神经元功能的影响。这种能力将有助于模拟发育中大脑未成熟神经元的电生理发育,以及了解特定神经退行性疾病的发病机制是如何影响神经元活动的。
- 在流动和静止条件下将分散的NPreCs-ZsG与BMVNs共同培养证实,神经发生(但不是神经元分化的百分比)因IF的应用而得到增强。在第14 d,流动条件下的ZsGreen1+细胞数量多于静止条件下的 ZsGreen1+细胞数量。仅根据 ZsGreen1+细胞的数量,不能断定NPreCs-ZsG的最终数量是由于NPreC的维持或增殖。内皮细胞衍生的 sAPP、层粘连蛋白、血管内皮生长因子和BTC都被证明能增加NSCs/NPCs的增殖。作者推测NPreCs-ZsG的最终数量是由细胞分裂造成的。此外,尽管流动和静止条件下Sox2+/ZsGreen1+细胞的平均数量没有显著差异,但在静止条件下观察到的Sox2+/ZsGreen1+细胞的百分比更高。总之,这些数据表明,IF增加了与BMVNs共同培养的NPreCs-ZsG的数量;但这些NPreCs-ZsG中表达Sox2的比例较低。这使作者推测,IF的应用促进了NPreC-ZsG的分化。与静态样本相比,第14 d的流动样本中观察到更多的MAP2+/ZsGreen1+细胞。然而,观察到流动培养和静态培养的MAP2+/ZsGreen1+细胞平均百分比没有差异。因此,流动条件下MAP2+/ZsGreen1+细胞数量较多可能是NPreCs-ZsG总数量较多的结果。结论是,IF通过促进更多MAP2+神经元的分化(而非百分比)来增强NPreC-ZsG的神经发生。
- 总之,本研究证明了人类NVN微流控模型能够识别和评估NPC的命运和行为影响因素。
- 在这项工作的前半部分,作者将NPC与由BECs、PCs和ACs组成的灌注BMVNs共同培养,以研究NPC的增殖和自我更新。确定了BECs、PCs和ACs在NPC-ZsG-Nsph存活和扩增中的有益作用。此外,还观察到自我更新的NPCs-ZsG直接与脑微血管接触,这证实了模型能够在体外再现人类NVN复杂的细胞相互作用。
- 在这项工作的后半部分,将NPreCs与BMVNs共同培养,以确定神经元分化对模型的影响。NPreC-Nsphs与BECs、PCs和ACs的共培养增强了神经发生,神经元突起的增加证实了这一点。此外,与BMVNs共同培养的NPreC-Nsphs产生了分化的 NPC 神经元,这些神经元表现出自发的钙振荡。这些结果证明了模型在体外评估神经元功能方面的潜力。当BMVNs与NPreC-Nsphs或分散的NPreCs-ZsG共同培养时,间质流的重要性得到了强调。应用IF可增强神经发生,具体表现为神经球的神经元生长和分化成熟的NPC神经元总数的增加。对与BMVNs共培养的分散NPreCs-ZsG中Sox2和MAP2表达的分析进一步验证了NVN模型在体外研究单个干细胞动态命运方面的功效。
- 最后,开发灌注的功能性BMVNs对临床前研究很有价值,可用于确定依赖血管输送的脑治疗药物的疗效。可以对目前的实验设计进行修改,以进一步研究人类胚胎发育过程中发生的神经血管相互作用以及神经退行性疾病。
Reference
Winkelman M A, Dai G. Bioengineered perfused human brain microvascular networks enhance neural progenitor cell survival, neurogenesis, and maturation[J]. Science Advances, 2023, 9(19): eaaz9499.



