
一种重力导向的微流体设备,将分散、凝胶化和萃取整合到一个连续的工作流程中。
Introduction
水凝胶具有广泛的可调特性、与原生细胞外基质相似,已被广泛用作三维细胞培养基质、组织工程支架以及药物和细胞递送载体。
- 大体积水凝胶中有限的扩散阻碍了营养物质和氧气的有效传输,导致细胞间交流受阻,甚至缺氧诱发细胞死亡;
- 小尺寸微凝胶还能进行高通量分析,允许进行治疗性注射,并在植入时诱发较少的免疫反应。
因此,小于100 μm的微凝胶可能更有利于生物医学应用。
液滴微流体技术是将水凝胶分散成微凝胶的一种极具吸引力的方法,因为这种方法允许高度单分散,并能以高通量改善对结构特性(如大小、形状、层次和区隔)的控制。然而,由于制备的微凝胶通常分散在不相溶的油相中,而正常的细胞活动需要水环境,因此后续程序几乎是不可避免的。传统上,凝胶化后的提取是通过循环离心(或脱乳化后过滤)和洗涤步骤分批进行的,这既耗时又低效。此外,同一批次中不同的凝胶化时间会导致连续暴露于潜在苛刻交联条件下的细胞存活率降低,例如光交联中的紫外线和离子交联中的酸性环境。 在接下来的萃取操作中,离心力或机械力以及破乳剂的存在往往会加剧对负载细胞的损伤。然而,由于不稳定液滴需要快速凝胶化,而牺牲油层又会阻碍化学交联剂的扩散,因此这些方法阻碍了交联方法的灵活性。此外,为了改进传统的提取方法,人们努力将破乳化过程整合到微流控芯片中,但细胞活力下降、批次内/批次间差异、微凝胶变形和聚集等问题虽然得到了缓解,但仍然存在。因此,将微凝胶从油乳液中回收到水介质中的片上萃取方法将进一步有助于解决基于液滴微流体技术的微凝胶制造过程中存在的问题,同时又不会对微凝胶的生成过程造成额外的限制。
现有片上提取方法的基本原理是首先通过主动或被动方法使微凝胶与水油界面接触。主动方法是指提供外力(如介电泳力或磁泳力)驱动微凝胶接近界面,这种方法依赖于额外的外围设备,对封装细胞可能有害。相比之下,通过高粘度流体或微型障碍物限制微凝胶的横向位移,从而迫使微凝胶接触界面的被动方法是简单易行的片上提取策略。然而,被动方法对于小尺寸和低刚度的微凝胶往往无效,因为微凝胶的直径减小,变形能力增强,很难缩短与界面的距离,也不容易从微障碍物之间的间隙中逃脱。因此,需要一种多功能、生物兼容的片上萃取方法来满足生物医学应用中对各种特性微凝胶的要求。
在此提出了一种集成微流控装置,用于端到端制造含有细胞的微凝胶,包括分散、凝胶化和提取。典型的流动聚焦几何原理可将前体溶液分散成单分散微滴,而海藻酸盐的酸诱导内部凝胶化可确保结构均匀性。作者开发了一种新颖的浮力辅助策略,即微流体装置的通道平面与重力平行(重力导向),以连续的方式将微凝胶从油相迅速提取到水相。微凝胶的萃取过程分为三个阶段:
- 微凝胶在浮力引导下接近界面并形成中间膜;
- 伪表面活性剂促进膜排出;
- 膜破裂。
由于微凝胶的表面性质在很大程度上受表面活性剂(表面活性剂和假表面活性剂)的影响,不同物理性质的微凝胶具有相似的表面性质。因此,可以想象这种方法是通用的,不同尺寸、硬度和材料的微凝胶验证了这一点。通过快速将封装细胞从恶劣环境中解救出来并避免外力可能造成的损伤,细胞活力在整个端到端连续制造过程中得以保持。这种生物相容性提取方法可与各种生成模块和交联方法相结合,从而端到端制造出具有不同特性的微凝胶,以满足细胞研究和临床治疗的需求。
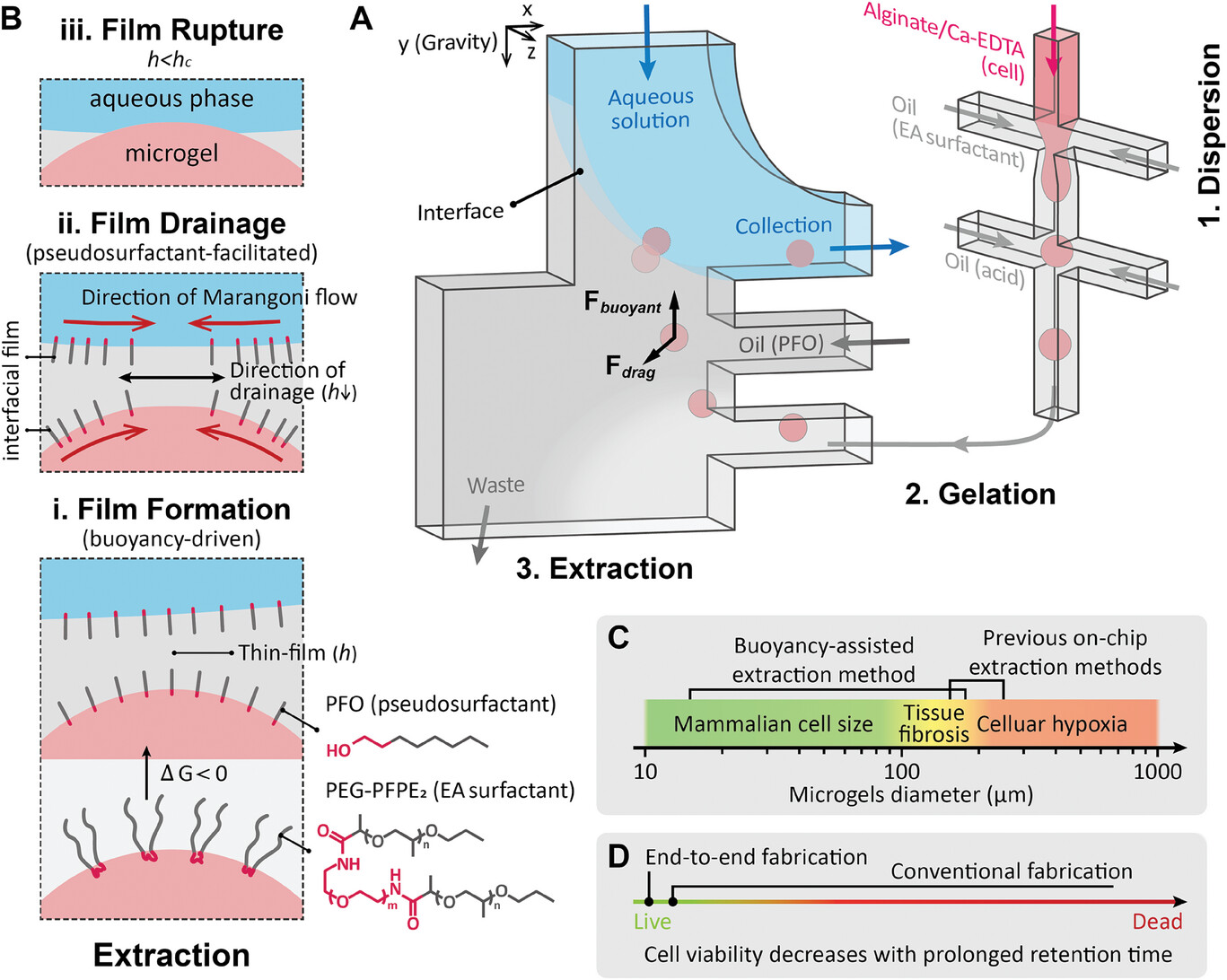
- (A)重力导向微流控装置示意图。分散、凝胶化和提取分别在上游芯片、连接管和下游芯片中进行。
- (B)微凝胶萃取过程中三个子过程的示意图:i) 浮力驱动的薄膜形成;ii) 伪表面活性剂促进的薄膜排水;iii) 短程力诱导的薄膜破裂(当薄膜厚度h降至临界厚度hc时)。两种表面活性剂的疏水全氟尾部和亲水极性头部分别用深色和红色表示。
- (C)浮力辅助法和之前的片上提取法可提取的微凝胶直径范围示意图。
- (D)在这种端到端方法中,通过缩短在恶劣环境中的保留时间,封装细胞的活力得以保持。
End-to-End Fabrication in the Gravity-Oriented Microfluidic Device
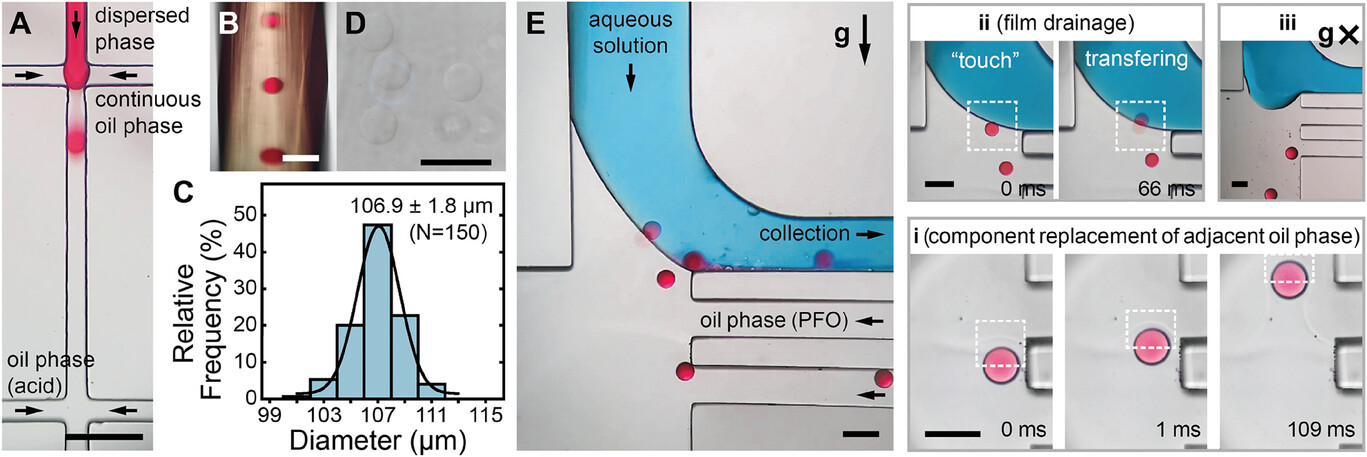
- (A)藻酸盐微滴在流动聚焦交界处形成。分散相、连续油相和含酸油相的体积流量分别为10、400和400 µL∙h-1。
- (B)微滴交联成微凝胶并被输送到下游芯片。
- (C-D)微凝胶的代表性白光图像和相应的尺寸分布直方图(平均直径为106.9 ± 1.8 µm,共150个微凝胶)。
- (E)微凝胶在下游芯片中的典型显微照片,包括进入腔室、漂浮、移入水相和流出。含PFO(30 vol%)的油相和水溶液的流速分别为100和1500 µL∙h-1。对子过程的详细描述:i) 成膜阶段微凝胶表面相邻成分的置换;ii) 排膜持续时间≈66 ms并瞬间破裂;iii) 当芯片的XY平面与重力正交时,微凝胶向废料出口移动。微凝胶和水溶液分别用品红色和蓝色标记。
Design and Construction of the Buoyancy-Assisted Extraction Method
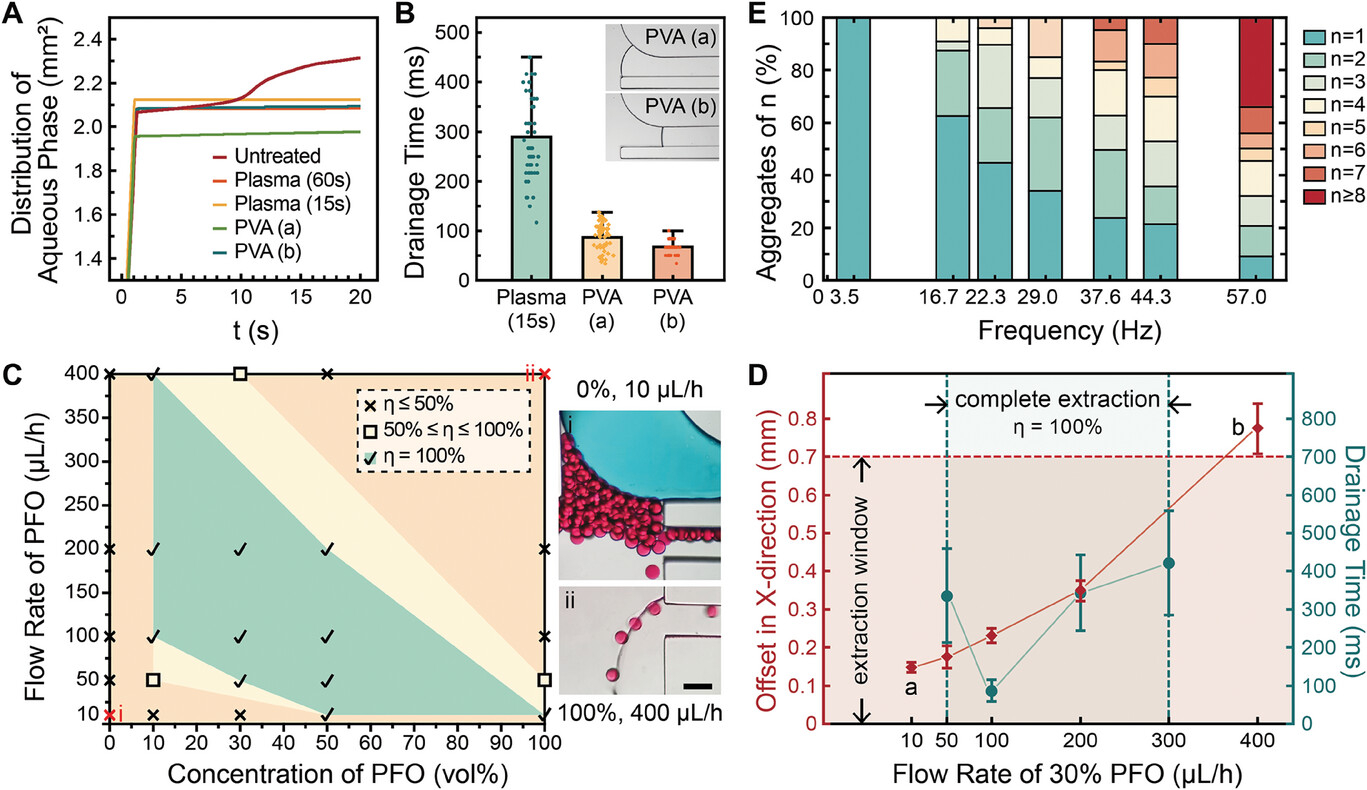
- (A)五种表面条件下水相随时间分布的建模结果。
- (B)排水时间随表面改性方法而变化。插图分别显示PVA沉积的a区和b区。
- (C)PFO的最佳浓度和流速可使微凝胶提取的回收率达到100%。当浓度和流速为i)0 vol%,10 µL∙h-1;ii)100 vol%,400 µL∙h-1,出现无法提取的经典失败情况。
- (D)含PFO油相的流速对轨迹和排水行为的影响,分别反映在X方向偏移(红色)和排水时间(绿色)上。萃取窗口范围(X 从0到700 µm)和完全萃取的流速条件(从50到300 µL∙h-1)分别标为红色和绿色区域。日期点(a)和(b)指的是排水速度太慢或微凝胶超过提取窗口时提取不完全的情况。
- (E)n-聚集体的百分比随生成频率而变化。
Wide Applicability of the Buoyancy-Assisted Extraction Method
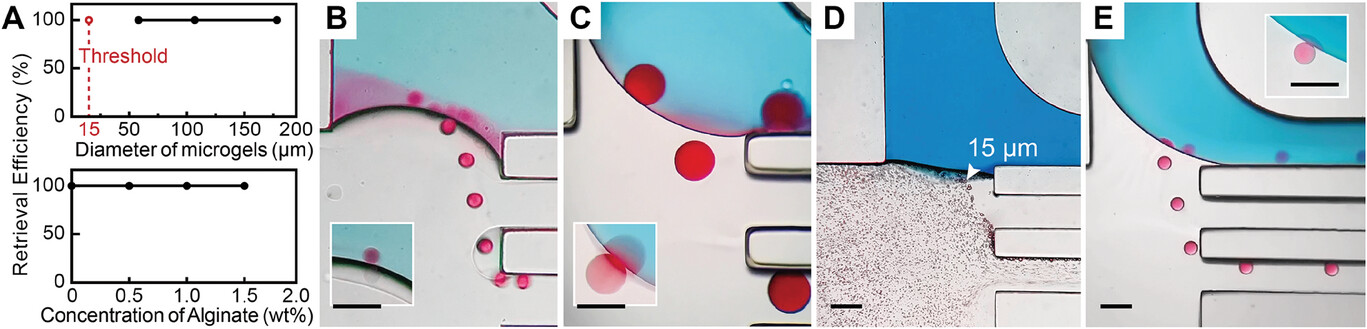
- (A)不同大小和硬度的微凝胶的提取效率。
- (B)1.5 wt%藻酸盐,58.1 µm微凝胶(50 vol% PFO,10 µL∙h-1);
- (C)1.5 wt%藻酸盐,178. 2 µm微凝胶(30 vol% PFO,100 µL∙h-1);
- (D)多分散未交联微滴(10 vol% PFO,50 µL∙h-1);
- (E)0.5 wt%藻酸盐,84.5 µm微凝胶(30 vol% PFO,100 µL∙h-1)。插图的曝光时间为1/240 s,显示微凝胶正在迁移。经等离子体处理的下游芯片用于提取小直径的微凝胶(B 和 D),这些微凝胶因表面弯曲而更容易迁移,并且不易因接触而粘附在亲水性PDMS表面。箭头所指为可提取的最小微凝胶(15 µm)。
Cell Encapsulation and Biocompatibility Assessment
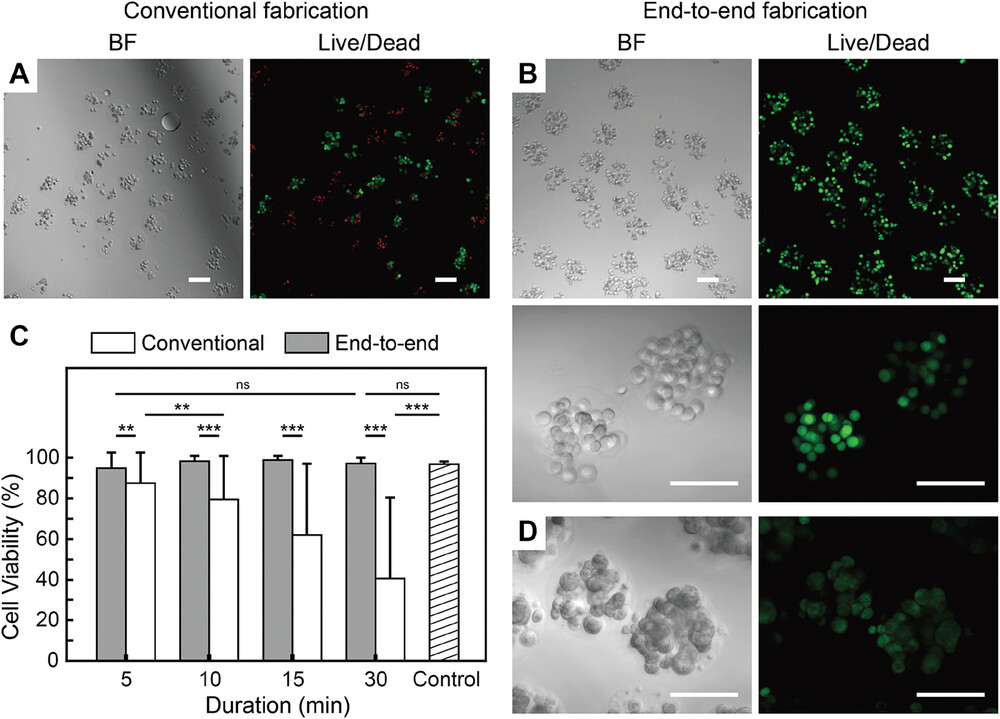
- (A)15 min芯片上制备并立即用芯片外方法提取;
- (B)15 min端对端制备;
- (C)30 min端对端制备并培养3 d的A549包被微凝胶的白光和共聚焦荧光图像。
- (D)通过传统方法和端到端方法制造的微凝胶中包被细胞在不同连续制造时间下的存活率比较。
Conclusion
开发出了一种多功能重力导向微流控装置,用于端到端制造含有细胞的微凝胶。该装置集成了微凝胶制造的整个工作流程,提出了一种新颖的片上提取策略,该策略主要基于薄膜排水理论进行设计,并通过数值模拟进行了进一步优化,最终通过实验进行了验证。在适当的表面特性、流速和含PFO油相浓度条件下,可完全萃取出各种尺寸(从15 μm到178 μm,为迄今报道的最宽)和硬度(从 1.74 kPa到 26.37 kPa)的单分散微凝胶;
此外,封装后A549细胞的存活率保持良好(高达 98.9% ± 2.0%),即使在连续制造长达半小时后,存活率仍可重复,且变化极小;
这种微流控装置有望扩展到其他水凝胶系统,如光交联水凝胶系统,以及进一步延长自动工作流程的后续微流控装置和高通量分析设备,如质谱仪和光散射仪。
Reference
Chen S, Wu Z, Zhang Q, et al. Gravity-Oriented Microfluidic Device for Biocompatible End-to-End Fabrication of Cell-Laden Microgels[J]. Small, 2024, 2306725.



