
一种基于三维打印模具口腔干细胞样细胞球芯片用于联合用药筛选。
Introduction
- 癌症治疗失败和癌症死亡人数呈上升趋势的部分原因是癌症的分子/物理异质性以及“一刀切”的癌症治疗方法。个性化和精准医学方法旨在通过为每位患者提供最适合的治疗方案来解决癌症的异质性问题。功能性药物测试(Functional drug testing,FDT)是在患者来源的肿瘤样本上测试各种药物分子,有可能指导最初的治疗决策并预测治疗结果。
- 头颈癌是印度最常见的五种癌症之一,约占所有癌症的40%。这就迫切需要在患者口腔肿瘤样本上开发FDT模型。众所周知,癌细胞会逃避药物机制途径,因此具有不同作用机制的药物组合比单一药物疗法更有益。口腔癌的FDT有助于发现潜在的药物组合。
- 广泛使用的FDT模型之一是基于三维肿瘤球的模型。基于微流控的三维肿瘤球模型能以最少的患者样本量进行药物测试,保持药物分子的动态传递,并保留内源性细胞信号分子。然而,之前报道的大量基于三维肿瘤球的微流控药物测试模型都因使用非患者特异性细胞而受到限制。因此,用于FDT的基于患者来源肿瘤球的微流控模型应运而生。之前报道的基于原发性肿瘤球的FDT模型非常有用。然而,静态药物治疗、单一药物治疗测试、缺乏临床相关性和较长的制作过程是需要解决的一些局限性。此外,该模型还应包括癌症干细胞样祖细胞,因为它们是导致化疗抵抗和肿瘤复发的原因。
- 头颈癌的个性化微流控模型仍有待彻底验证,因为在过去十年中,涉及口腔肿瘤细胞三维培养的报道很少。虽然这些模型提供了针对患者的药物测试结果,但它们缺乏观察到的药物反应的确凿临床相关性。此外,它们没有评估体外肿瘤模型中的氧含量,而众所周知,氧含量会影响FDT读数。此外,头颈部癌症还缺乏基于患者来源干细胞球的微流控模型。针对上述挑战,作者提出了一种基于软光刻模具的个性化三维打印动态口腔干样球体模型。该模型能够同时测试三种抗癌药物的七种组合。该装置设计独特,包含七个蛇形环路,便于在将药物组合引入三维球形区域之前进行混合。为了创建这些三维细胞球,七个圆柱形微孔阵列被战略性地放置在每个蛇形环路的末端。
- 光刻技术已被广泛用于制造具有出色表面光洁度和尺寸精度的微流体通道。然而,基于三维打印模具的方法因其优于光刻技术而成为潜在的竞争者。因此,在本研究中,作者评估并比较了各种光固化三维打印树脂在复制成型中用于制造芯片上细胞球的效果。
- 作者假设所设计的微流控装置将能够为每位口腔癌患者确定最有效、最适合的药物组合,评估了将肿瘤芯片用于个性化医疗的可行性。
- 介绍了该装置的设计和计算验证。
- 开发了一种细胞接种策略,以确保在七个微孔阵列中形成大小一致的球体。
- 比较了用各种三维打印软光刻模具生产的聚二甲基硅氧烷(PDMS)装置的光学透明度、表面粗糙度和尺寸精度。在对各种光固化树脂进行比较后,最终确定了器件制造策略。
- 对装置进行了混合表征和表面表征。
- 用MCF 7细胞系测试了所设计的细胞接种策略和制造方法。
- 从三名口腔癌患者的活检样本中分离出了口腔肿瘤干样细胞,并用著名的癌症干细胞标记物对其进行了表征。
- 在口腔细胞球上演示了使用知名口腔癌化疗方案(包括紫杉醇、5 氟尿嘧啶和顺铂)的 FDT。更重要的是,作者从I/II期临床试验中选择了与临床推荐剂量相关的药物最大血浆浓度(Cmax)。使用最大血浆浓度的目的是使药物在细胞球上产生与原生肿瘤在最大血浆浓度时相似的效果。在此假设药物动力学稳定状态下肿瘤组织中的药物浓度与血浆中的药物浓度相同。
- 最后根据患者衍生细胞球的缺氧染料染色、形态和大小,介绍了观察到的药物反应的临床相关性。
Microfluidic device design and computational validation

- (A)用于细胞培养的底层示意图和药物灌注方案。
- (B)用于流体交换的顶层示意图。
- (C)在长度为57 mm的蛇形通道中进行的混合模拟。
- (D)通道网络中的速度曲线,显示入口和出口细胞培养区的最大流速。
- (E)微孔内速度流线。
- (F)药物在微孔中的传输时间:(i) 200 s,(ii) 800 s。
Primary oral tumor stem-like cells isolation, characterization, and culture in the device
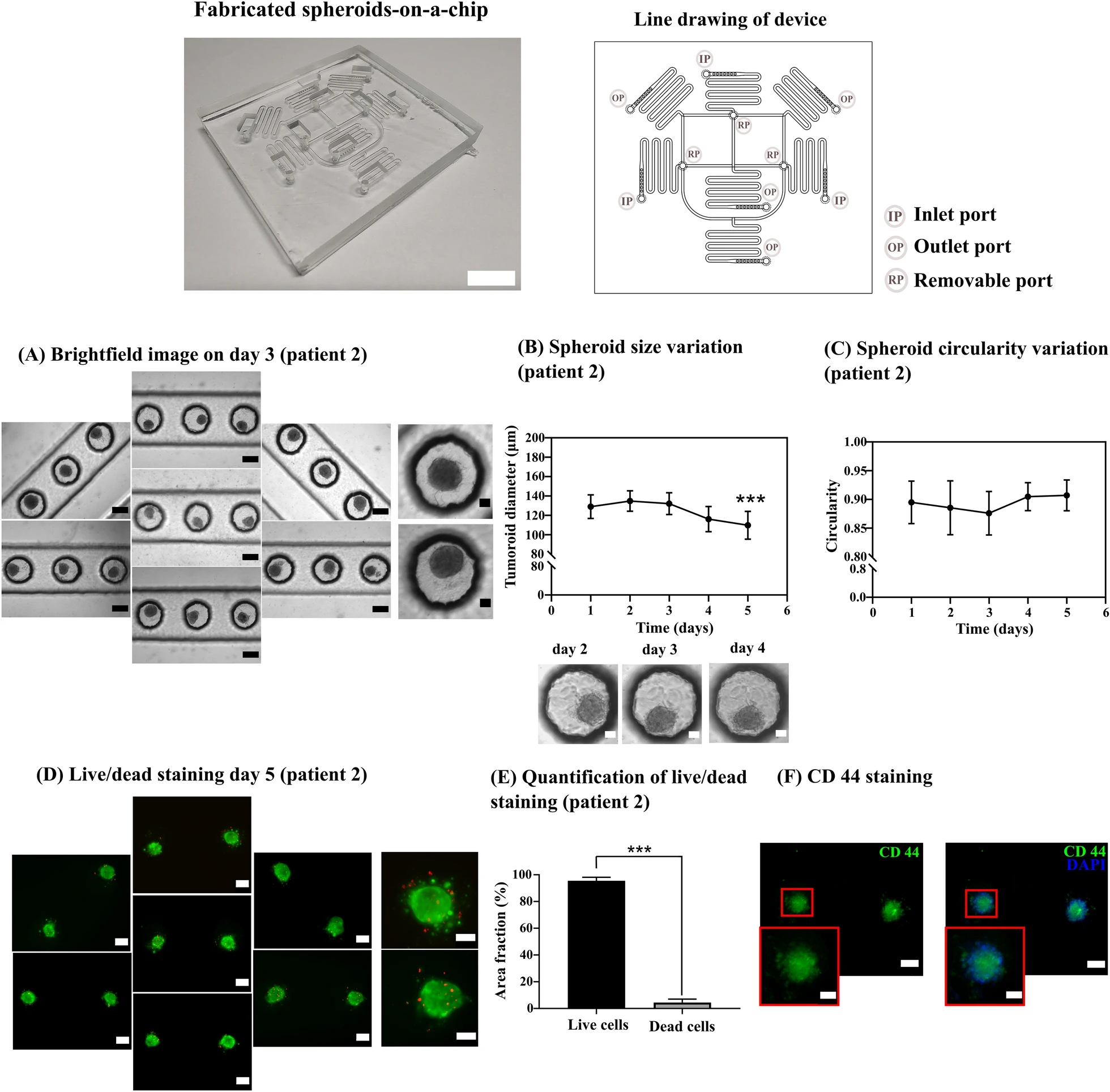
- (A)患者2衍生的原发性口腔干样肿瘤细胞以12 µl/min的流速接种。第3 d捕获细胞球的白光图像。
- (B)用ImageJ测量的细胞球大小随时间的变化。
- (C)用ImageJ测量的细胞球圆度随时间的变化。
- (D)第5 d活细胞/死细胞染色显示。
- (E)第 5 d活细胞/死细胞染色的定量。
- (F)用CD 44标记免疫荧光,显示绿色细胞CD 44阳性,蓝色显示DAPI染色。
Personalized combinatorial drug screening
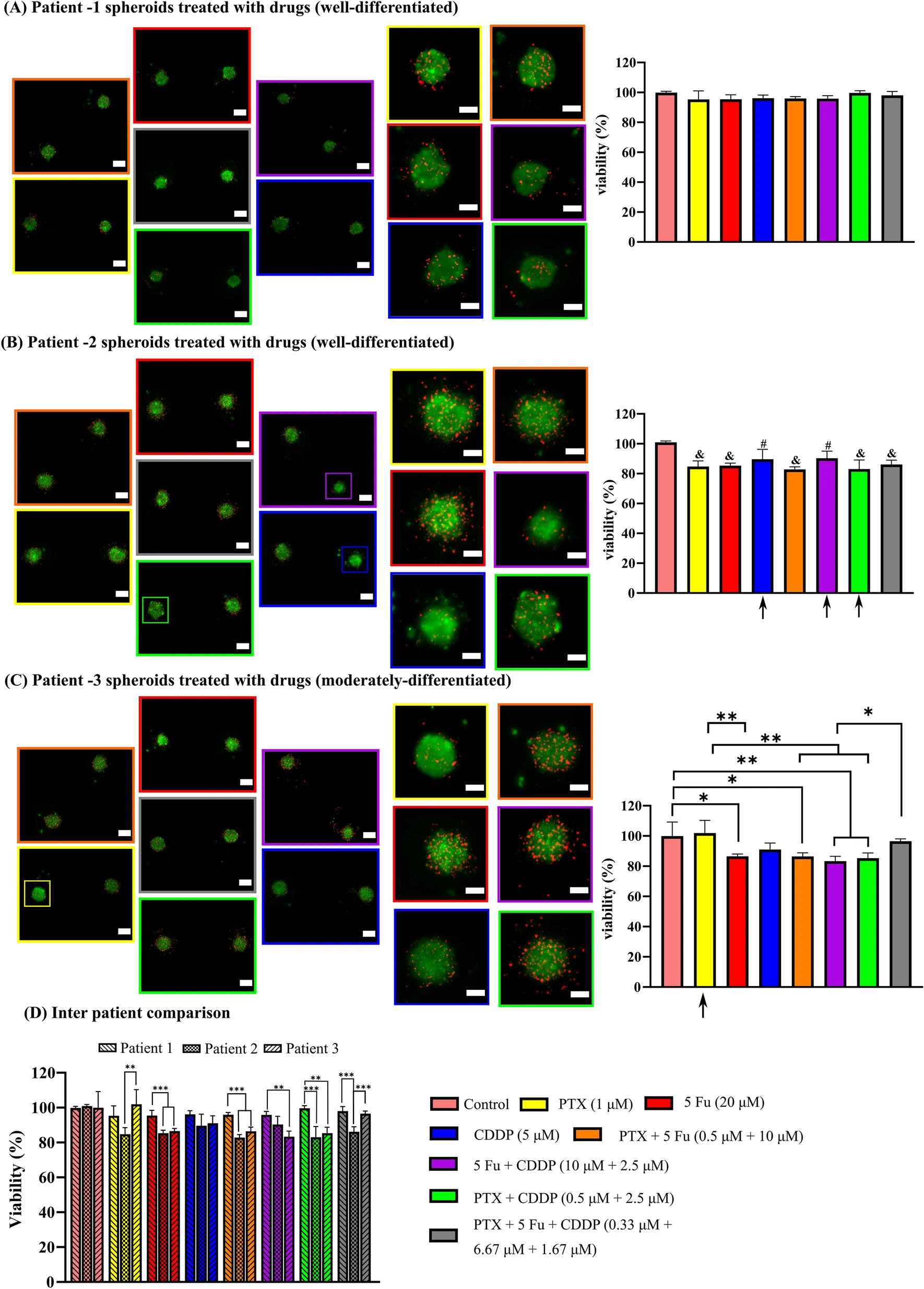
- (A)患者1的细胞球活死染色。可能表明患者对所有七种药物组合都有很强的抗药性
- (B)患者2的细胞球活死染色。可能表明患者2衍生的细胞球内存在顺铂耐药性。由于单个药物组之间没有明显差异,使用紫杉醇 + 5 Fu和所有三种药物(紫杉醇 + 5 Fu + 顺铂)治疗可能表明联合用药具有相加效应(联合指数 = 1)。由此可以得出结论,对于患者2的治疗,三种药物的联合治疗,或紫杉醇和5-Fu的配对联合治疗,甚至使用紫杉醇或5-Fu的单一疗法,都可能被证明是有益的。
- (C)患者3的细胞球活死染色。可能表明肿瘤对5 Fu单药治疗的反应优于紫杉醇。因此,5 Fu单药疗法或三种配对组合疗法之一对患者3有效。
- (D)患者间比较。总体而言,来自所有三名患者的球体对各种药物组合的反应差异显著,这些反应表明在临床相关剂量下患者间存在异质性。
Evaluation of morphology/oxygen levels of oral spheroids
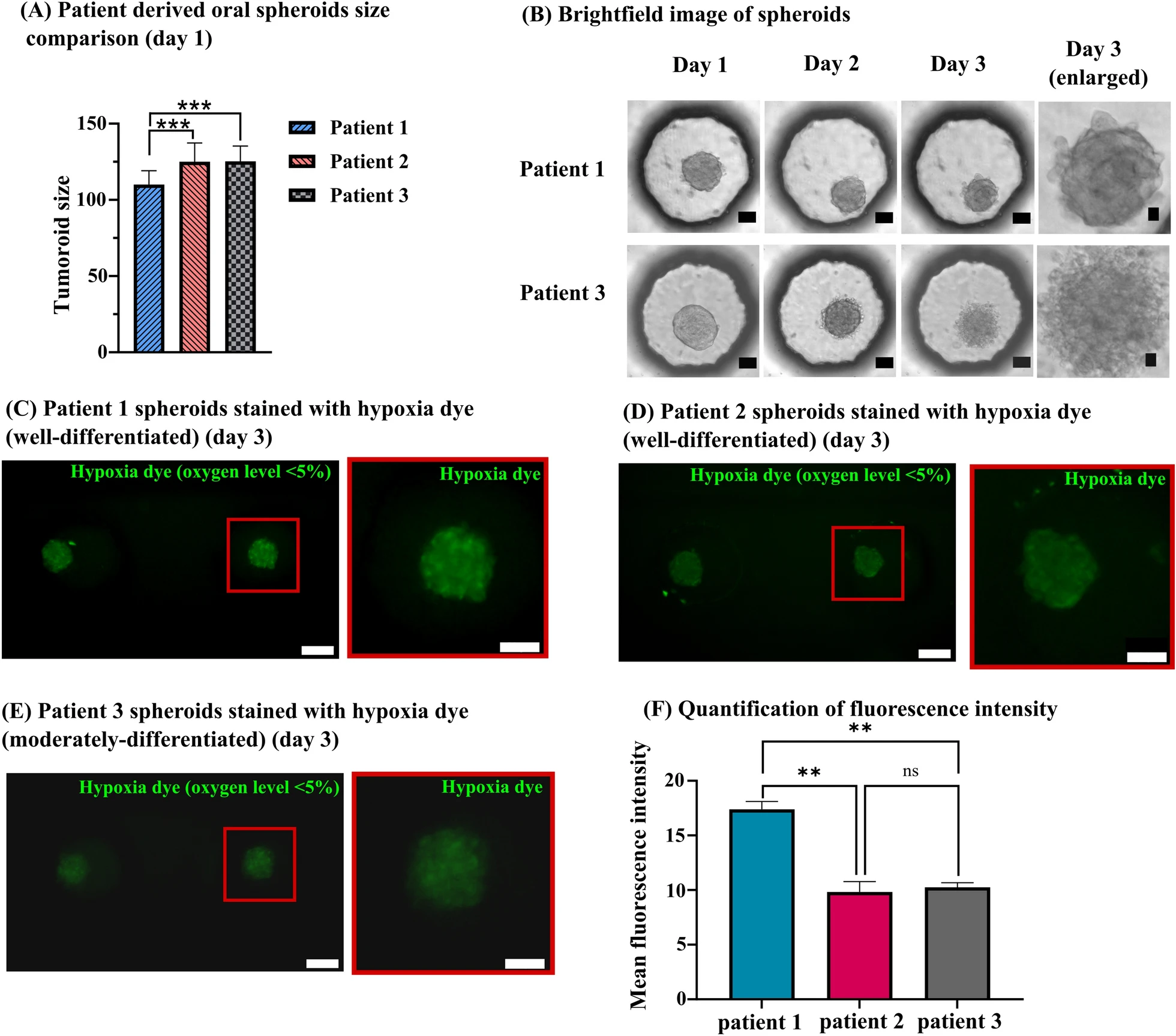
- (A)患者衍生细胞球第1 d的大小比较。
- (B)白光图显示患者1和患者3的细胞球从第1 d到第3 d的形态变化。与中度分化的患者3衍生球体相比,患者1和患者2的高分化细胞球显示出相对更紧密的细胞连接。
- (C)第3 d iT-绿色缺氧试剂在患者1细胞球中的表达图像。
- (D)第3 d iT-绿色缺氧试剂在患者2细胞球中的表达图像。
- (E)第3 d iT-绿色缺氧试剂在患者3细胞球中的表达图像。
- (F)缺氧染料荧光强度定量。
Discussion
在本研究中,作者开发了一种个性化口腔干细胞芯片系统。该系统成功捕捉了患者间的肿瘤异质性,确定了最有效的药物组合、治疗抗药性,并揭示了患者在球体形态、大小和氧含量方面的特异性差异。
球体形态和大小的临床相关性:
- 患者1和患者2被诊断为分化良好的口腔鳞状细胞癌,患者3被诊断为中度分化的口腔鳞状细胞癌。众所周知,中度分化和分化不良的肿瘤比分化良好的肿瘤更具侵袭性和侵袭性。此外,中度分化肿瘤的E-cadherin表达水平也低于分化良好的肿瘤 。E-cadherin的低表达导致细胞-细胞接触减少,尤其是在FaDu、Hep2和Hep2-Tax衍生的头颈癌球体内的边界区域。作者发现患者3衍生的中度分化球形体在边界区域的细胞-细胞接触减少,而患者1和患者2衍生的高分化球形体保持了紧密的细胞连接。此外,先前的胰腺癌研究也发现了类似的观察结果。Capan-1细胞系来自分化良好的癌症,表现出明显的紧密边界,而BxPc-3细胞系球形体则与之相反,后者来自中度分化的肿瘤,在其边界区域显示出松散粘附的细胞。
- 与来自患者2和3的细胞球相比,来自患者1的细胞球的平均体积明显较小,这意味着细胞球中E-cadherin的积累更多。因此,较高的E-cadherin水平可能导致增殖抑制,这也是其体积缩小的原因。不过,有必要通过流式细胞术分析来评估球体内E-cadherin的表达情况,从而进一步验证这一假设。
球体内氧含量差异分析:
- 所有三个源自患者的细胞球都表达了氧含量低于5%的区域。患者1的球体缺氧染料表达最亮。除了PDMS的气体渗透性限制外,作者认为患者1的球形体体积较小,E-cadherin积累较多,可能减小了细胞内的氧扩散空间,导致氧浓度最低。
- 此外,还观察到不同患者特异性缺氧染料的表达,这种表达并不局限于球体的中心核心区域。这一观察结果与之前的研究结果一致,即在源自不同患者的四种头颈癌细胞系中发现了不同的缺氧染料表达。该研究还表明,OSC-19球形细胞中的缺氧染料表达在整个球形细胞中均匀分布。
- 正常组织一般具有5%的氧气浓度(缺氧)。但研究发现,癌症的中位氧含量要低得多(≤ 4.2% O2)。头颈部实体瘤通常表现为生理性缺氧,氧含量在1-2%之间。这表明,设备成功地将细胞球维持在与头颈部实体瘤相关的氧气水平,而不会对其5 d的存活率产生不利影响。
- 实体瘤中癌症干细胞和缺氧区域的存在与不良预后和治疗效果有关。因此,所开发的模型适用于测试对缺氧区域和根除癌症干细胞群有效的潜在药物组合。
分析异质性药物反应和临床相关性:
最后使用了著名的口服癌症化疗方案,包括紫杉醇、5 Fu和顺铂,用于FDT。作者发现,患者1的细胞球对各种药物组合的耐药性最高,而患者2和3的细胞球对这些药物组合的反应各不相同。
在患者1的细胞球中观察到的最高耐药性可以用其中最高的缺氧染料表达来解释。缺氧可能是头颈部癌症细胞休眠的原因之一。由于化疗药物作用于快速分裂的细胞,缺氧区域的休眠或缓慢分裂的细胞部分可能不会对化疗药物产生反应。与患者2和3的球形体相比,患者1的细胞球中缺氧染料的表达量更大,这表明其中细胞的增殖率相对较低,这也是患者1的细胞球表现出耐药性的原因。此外,如前所述,患者1的球体内E-cadherin积累较多,导致增殖率较低,这也是耐药性较强的原因。
对顺铂及其联合用药的敏感性降低仍然是头颈癌化疗中的一项挑战 。先前的研究发现了一组预测头颈癌患者顺铂耐药性的基因。我们认为,要确认本研究中捕捉到的顺铂耐药性背后的确切机制,还需要进行患者特异性基因表达研究。
此外,在其他有反应的细胞球样本中,有少数细胞球样本对顺铂及其联合用药(患者2)的敏感性降低,这也可能表明患者内部存在异质性。正如之前的研究所报告的那样,患者内异质性是基于微流控装置的功能性药物测试所面临的一个严峻挑战。
新近的文献显示,癌症干细胞有两种群体共存:(1)EMT:间充质型;(2)非EMT:上皮型。这两种细胞群在患者口腔肿瘤的患者内部水平产生了表型多样性。
作者选择了6 h的动态药物治疗时间。24 h化疗药物灌注的典型浓度与时间曲线的斜率被假定为在6 h的短时间内恒定在血浆峰值水平附近。因此,作者认为6 h内恒定Cmax的药物灌注能可靠地复制原生肿瘤所经历的药物效应。更长的灌注时间可能会产生更大的细胞毒性,但会明显夸大药物的作用,导致对药物反应的误读。不过,未来的努力方向应该是让球形体接触整个药代动力学曲线,并重复给药以达到IC50。
众所周知,PDMS可吸附药物等小分子。然而,正如最近的研究所示,在PDMS上引入聚乙二醇 (PEG) 分子会将药物吸附性降至最低。因此,我们将广泛使用的含PEG的三嵌段共聚物pluronic F127涂覆在PDMS上,以防止这种非特异性吸附。通常情况下,此类三嵌段共聚物还能防止细胞粘附,并通过聚乙二醇基团形成球形,而众所周知,聚乙二醇基团能通过立体排斥作用防止蛋白质吸附。不过,作者也承认,现有的基于聚乙二醇的策略可能无法完全防止药物吸附。因此,其他聚合物,如聚甲基丙烯酸甲酯 (PMMA)、聚苯乙烯 (PS)、聚碳酸酯 (PC)、环烯烃共聚物 (COC) 等也可作为微流控材料进行研究。
该平台与现有文献的比较:
以前报道的大多数平台都使用永生癌细胞系或PDX细胞系。过去6年中只有极少数研究使用了从新鲜患者组织中分离出来的原代细胞,大多数研究(70%)使用的是永生癌细胞系。虽然癌细胞系具有良好的重现性、广泛的传代能力和高增殖能力,但众所周知,细胞系并不能完全代表体内肿瘤的相关模型,因为在细胞永生化过程中可能会发生不确定的转录组、表观遗传、基因和表型变化。此外,它们也不能再现患者间的异质性,而这种异质性对于个性化功能药物测试至关重要,我们的研究使用原代癌细胞就能捕捉到这种异质性。
以口腔癌为重点的个性化药物筛选研究很少见。在过去15年中,大多数研究都集中在乳腺癌、肺癌、结肠直肠癌和胰腺癌上。此外,关注癌症祖细胞群(癌症干细胞)的论文在片上细胞球中也很少见,众所周知,癌症干细胞具有化疗抗性,是癌症复发的原因之一。
此外,只有一项研究报告了培养球体内的缺氧水平。缺氧主要是缺氧诱导因子(HIFs)引起的反应,是肿瘤进展和耐药性的关键因素。在患者1衍生的球体内观察到的最高耐药性与患者1球体内最高的缺氧染料表达相关,这表明了在体外培养中保持体内氧水平的重要性。
没有一项研究报告了药物筛选结果与患者临床组织病理学数据的相关性,没有一篇论文根据患者的肿瘤分化状况观察到不同的细胞球形态。因此,作者认为该论文有别于之前发表的相关论文。
最后,很少有论文报道使用三维打印技术制造片上肿瘤。此外,以前的论文都没有在与我们的研究相同的深度和广度上比较过用于制造片上球形体的三维打印材料。
在动态流动和5%氧气水平下观察到的代表患者肿瘤分化状态的形态学差异在基于孔板的静态培养中并不存在。由于缺氧条件和致密性,患者1衍生的球形体在微流控平台上对药物治疗具有抗药性,这与静态孔板培养物上观察到的结果截然不同。因此,与传统的孔板培养相比,微流控平台有可能更好地深入了解患者衍生样本。
这项工作的几个局限性包括缺乏功能性血管、缺乏其他细胞类型以及缺乏分子研究。血管是肿瘤微环境不可分割的一部分,有助于捕捉肿瘤球体在体外的实际药物暴露情况。此外,体外血管还可以测试抗血管生成疗法。作者表示将在今后与内皮细胞共同培养的工作中对此进行探索。
原位成像是对芯片细胞球进行定性和定量表征的最主要技术。此外,一个芯片上的细胞数量不足和无法从芯片上获取细胞球是本文缺乏分子研究的两个主要限制因素。为解决这一限制,作者将增加微孔数量,并在改进设计中引入更多细胞,以获得足够数量的RNA。此外,作者目前还在优化以500-1000微升/分钟的高流速从芯片中回收细胞球的方法。
只有一项研究在个性化医学研究中纳入了三个以上的患者样本。因此,作者认为三个病人的样本量足以证明该平台的概念验证。不过未来的研究将包括更多的患者样本,以证明该平台的临床实用性。此外还将使用与患者用药相同的药物治疗细胞球,以便将设备数据与临床结果直接关联起来。
CD44是头颈部癌症中最重要和最广泛报道的CSC标志物之一,这一点已被之前纳入患者数据的研究证实。如图2F所示,微流控装置中生长的细胞球显示出CD44的高阳性表达,证实了干细胞样特性的维持。然而,缺乏其他标记物,如Oct-4、Sox2、Nanog和SSEA-1,是该研究的一个局限。
肿瘤微环境包括其他细胞类型,如成纤维细胞、免疫细胞和内皮细胞。此外,基质细胞对药物反应也有很大影响。作者相信,在未来的研究中,将基质细胞和肿瘤细胞共同培养在所开发的设备中将能更准确地捕捉肿瘤的复杂性。
Conclusion
- 在这项研究中,作者报告了一种基于三维打印的新型设备,该设备能够捕捉患者间肿瘤的异质性,确定最有效的药物组合、治疗抗药性,并揭示患者在球体形态、大小和氧含量方面的特异性差异。这些特征还与每位患者的临床组织病理诊断报告相关联。
- 在微流控系统中培养的口腔球体表达了癌症干性标志物(CD44+),并在5天内保持了较高的存活率。在患者 1 衍生的球体内捕获到的最高耐药性与球体内的最低氧气水平相关。有趣的是,很少有药物组合在微流控芯片上产生叠加和协同效应。据我们所知,这是第一份关于开发基于微流控的口腔癌球形模型用于个性化组合药物筛选的大量工作的报告。
- 此外,与之前报道的基于微流控芯片的个性化细胞球模型设备相比,所获得的药物筛选数据的临床相关性是一项重大进步。最后,在与口腔癌相关的氧气水平低于5%的条件下,患者来源的球形体仍能保持较高的存活率,这在我们开发的设备中更真实地再现了实体肿瘤的微环境。
Reference
Mehta V, Vilikkathala Sudhakaran S, Nellore V, et al. 3D stem-like spheroids-on-a-chip for personalized combinatorial drug testing in oral cancer[J]. Journal of Nanobiotechnology, 2024, 22(1): 344.


